  |
- ENLACE QUÍMICO
- ENLACE IÓNICO
-
ENLACE IÓNICO. PROPIEDADES DOS COMPOSTOS IÓNICOS
-
ENLACE COVALENTE. ESTRUTURAS DE LEWIS
-
ENLACE COVALENTE. POLARIDADE DOS ENLACES
-
ENLACE COVALENTE. PROPIEDADES DOS COMPOSTOS COVALENTES
-
ENLACE METÁLICO. MODELO DO GAS ELECTRÓNICO
-
ENLACE METÁLICO. PROPIEDADES DOS COMPOSTOS METÁLICOS
- FUERZAS INTERMOLECULARES
- FORMULACIÓN INORGÁNICA
Ada E. Yonath, israelí, recibiu en 2009 o
Premio Nobel de Química xunto con Venkatraman Ramakrishnan e Thomas A.
Steitz polos seus estudos sobre a estrutura e función do ribosoma.
O seu traballo centrouse na determinación e o estudo da
estrutura dos ribosomas, macromoléculas responsables da síntese de
proteínas e o modo de acción dos antibióticos. Introduciu unha nova
técnica, a criobiocristalografía, na cal os cristais de materiais
biolóxicos sensible á radiación son arrefriados a temperaturas menores
de 100 K, o que facilita o seu estudo por raios X.
|
|
ENLACE QUÍMICO
|
|
A razón que fai que os átomos se unan é a razón que move
todos os cambios da natureza, os átomos únense para conseguir máis
estabilidade. A maior parte dos átomos son máis estables xuntos que
separados. Tentaremos comprender por que.
Imaxina dous átomos a gran distancia. Se son máis
estables unidos que separados cando se acheguen é porque as forzas de
atracción serán favorables para a formación da ligazón. Cales poden
ser estas forzas? pois as interaccións dos electróns dun átomo cos
protóns do outro e viceversa. Pero a medida que se acheguen tamén
estarán sometidos a forzas de repulsión, as establecidas entre os
electróns dun átomo e os do outro, ou as interaccións entre os núcleos
dos dous átomos. Chegará un momento en que as forzas atractivas
maximízanse e as repulsivas minimízanse, neste momento os núcleos
estarán a unha distancia que chamaremos distancia de enlace. Xa
non se poden xuntar máis pois se repelerían, nin se poden separar pois
se atraerían. Diremos que quedaron enlazados. Esta distancia de ligazón
correspóndese cunha enerxía que chamaremos enerxía de enlace.
Chamamos enlace químico á interacción que se dá entre
os átomos cando se unen para dar moléculas ou redes cristalinas.
Para entender por que se estabilizan os átomos ao formar
enlaces é útil fixarse nos únicos elementos da Táboa que non teñen
tendencia a asociarse, son tan estables que non necesitan unirse a
outros átomos. Son os gases nobres. Non foi fácil descubrilos
pois existen en pequenas cantidades no aire. Houbo que licuar o aire
para obtelos illados. Máis fantástica é a historia do helio, He, que foi
descuberto antes no Sol que na Terra.
Por que son tan estables os gases nobres? O único que
diferencia aos gases nobres dos demais elementos é que teñen as capas
electrónicas completas, con máis propiedade, teñen 8 electróns na capa
máis externa, os dous electróns s, e os seis electróns p. Ter esta
configuración ns2 np6 debe de conferir gran
estabilidade aos átomos. Esta configuración coñécese como
configuración de gas nobre.
Todos os demais átomos tenden a conseguir esta
configuración de gas nobre cando se combinan con outros átomos. Este
comportamento denominámolo Regra do octeto: Os átomos cando se
asocian con outros átomos tenden a gañar, perder ou compartir electróns
para conseguir configuración de gas nobre.
Ben, xa vimos que para conseguir estabilidade os átomos
deben conseguir configuración de gas nobre, e para conseguir esta
configuración deben de gañar, perder ou compartir electróns. En función
de como se comporten os átomos para conseguir configuración de gas nobre
atopamos tres enfoques diferentes para o problema do enlace: Enlace
iónico, enlace covalente e enlace metálico.
Comproba as interaccións atractivas e
repulsivas entre átomos utilizando esta simulación da Universidade de
Colorado:
EXERCICIOS
PARA PRACTICAR

|
|
ENLACE IÓNICO
|
|
Que ocorre cando temos dous átomos de moi diferente
electronegatividade? Por exemplo un metal como o sodio, Na, e un non
metal como o cloro, Cl. As súas configuracións electrónicas son: [11Na] = 1s2 2s2
2p6 3s1
[17Cl] = 1s2 2s2
2p6 3s2 3p2 3p2 3p1
Para que estes átomos consigan máis estabilidade deben
conseguir configuración de gas nobre, pódena conseguir se o sodio perde
un electrón, e este electrón gáñao o cloro. É dicir transfírese un
electrón do sodio ao cloro:
[11Na+] = 1s2
2s2 2p6
[17Cl−] = 1s2
2s2 2p6 3s2 3p6
Vemos que se forman dous ións,
o metal dá lugar a un ión positivo e o non metal a un ión negativo.
Estes ións atráense por forzas de tipo electrostático de Coulomb, pero
non se tocarán, xa que a pequenas distancias as forzas de repulsión
entre as capas electrónicas dos dous ións separaríanos. Por tanto
manteranse ligados entre eles a certa distancia.
Como non teremos só dous ións,
teremos moitísimos, cada ión dun signo rodearase do maior número de ións
de signo contrario, formándose unha rede cristalina de ións positivos e
negativos. No caso do cloruro de sodio, NaCl, esta rede será:
O índice de coordinación, ou
ións dun signo que rodean a outro de signo contrario, a unha distancia
mínima, nesta rede é 6. Cada ión Na+ está rodeado de 6 ións
Cl−, e cada ión Cl− está rodeado de 6 ións Na+.
Esta rede cristalina coñécese como rede cúbica centrada nas caras.
Podemos atopar redes cristalinas con maior índice de
coordinación, así a rede do CsCl presenta un índice de coordinación 8,
cada ión Cs+ rodéase de 8 ións Cl−, e cada ión Cl−
rodéase de 8 ións Cs+. Esta rede cristalina coñécese como
rede cúbica centrada no corpo.
De que depende que unhas redes cristalinas presenten
unha disposición de ións diferentes doutras? A diferenza está nas
características dos ións, nos seus tamaños relativos e nas súas cargas
eléctricas. Para unhas características dadas os ións buscarán a
estrutura máis estable.
Cando os ións non teñen a mesma carga, en valor
absoluto, non hai o mesmo número de ións que rodean a outro de signo
contrario. Por exemplo na fluorita, CaF2, cada ión F−
está rodeado de 4 ións Ca2+, e cada ión Ca2+ está
rodeado por 8 ións F−.
Esta tamén é unha estrutura cúbica centrada nas caras,
pero de tipo fluorita.
Podemos estudar desde o punto de vista enerxético a
formación do cristal iónico, Supoñamos que temos os elementos que forman
o cristal e queremos chegar ao composto iónico. A enerxía involucrada
neste proceso é a entalpía de formación do cristal cando o proceso está
realizado a presión constante. Se se forma o cristal esta enerxía debe
ter un valor negativo. Pero este proceso podémolo levar a cabo a través
doutros pasos intermedios, xa que a entalpía é unha función de estado, e
só depende dos estados inicial e final. O ciclo de reaccións que nos
leva destas dúas formas diferentes ata o cristal coñécese como ciclo de
Born-Haber.
Ciclo de Born-Haber: Permítenos calcular a
enerxía de rede aplicando a lei de Hess.
Observamos así que o proceso máis favorable na formación
do cristal iónico é a formación da rede cristalina. A enerxía
involucrada en conseguir o cristal iónico a partir dos ións en estado
gas é a entalpía reticular ou entalpía de rede.
Ecuación de Born-Landé: Permite calcular a
entalpía de rede a partir duns parámetros dependentes dos ións e outros
característicos da rede cristalina.
Z+ y Z− = cargas dos ions
e = carga do electrón
NA = número de Avogadro
A = constante de Madelung, depende do tipo de rede cristalina
ε0 = permitividade do baleiro
r0 = distancia entre os centros dos ions
n = factor de compresibilidade de Born
Se comparamos compostos que presentan a mesma rede
cristalina a enerxía de rede será proporcional ao seguinte cociente:
Neste caso, se temos dous compostos iónicos que
cristalizan na mesma rede, avaliando como varían as cargas dos ións, ou
as distancias entre os mesmos, podemos coñecer que composto presentará
maior enerxía de rede.
Lembra que podes recristalizar sales para obter cristais
grandes e ben formados, como podes ver neste vídeo:

|
|
ENLACE
IÓNICO.
PROPIEDADES DOS COMPOSTOS IÓNICOS |
|
Os compostos iónicos presentan unhas propiedades resumidas nesta
táboa:
|
PROPIEDADES DAS
SUSTANCIAS IÓNICAS |
| Propiedade |
Característica |
Por
que? |
| Estructura |
Redes cristalinas formadas por ións. |
Os ións de distinto
signo atráense e rodéanse do maior número de ións de signo
contrario, formando unha rede cristalina iónica. |
| Estado
físico |
Sólidas |
O gran número de ións
que forman a rede fai que se presente en estado sólido |
| Puntos de
fusión e ebulición |
Altos |
Os enlaces iónicos son
ligazóns fortes, difíciles de romper. Os puntos de fusión e
ebulición serán máis altos nos compostos iónicos con maiores
enerxías de rede. |
| Dureza |
Son duras pero tamén fráxiles |
Son duras porque as
ligazóns son fortes, pero son fráxiles pois ao golpealas as capas de
ións desprázanse entrando en contacto ións do mesmos signo que se
repelen. |
| Solubilidade |
Algunhas son solubles en auga
e disolventes
polares |
As moléculas polares
como a auga rodean os ións e sepáranos da rede se as forzas de
interacción entre o ión e a auga son maiores que entre o ión e o
resto da rede. Se a enerxía de rede é grande a súa solubilidade será
moi baixa. |
| Conductividade
eléctrica |
Conducen a corrente en disolución
ou fundidas |
Para que haxa
condutividade debe haber movemento de cargas, os ións só pódense
mover cando están disoltos ou en estado líquido, nos sales fundidos |
|
Exemplos |
Cloruro de sodio, NaCl |
 |
|
Sulfato de cobre, CuSO4·5H2O |
 |
|
Calcita, CaCO3 |
 |
|
Outros: Sales: CaSO4, Na2CO3,
NH4NO3. Óxidos: CaO, Fe2O3.
Hidróxidos: NaOH, Ba(OH)2. |
EXERCICIOS
PARA PRACTICAR

|
|
ENLACE COVALENTE. ESTRUTURAS
DE LEWIS |
|
Que ocorre cando os elementos que se enlazan son dous
non metais? Os non metais tenden a gañar electróns para conseguir
configuración de gas nobre, pero para que un átomo gañe electróns debe
haber outro que os perda, como pasaba no enlace iónico, pero agora todos
os átomos teñen necesidade de electróns. Neste caso os átomos
necesitados de electróns téñenos que conseguir por outro procedemento
que será compartindo electróns. Os átomos achegaranse ata que as súas
nubes electrónicas solapen e poidan compartir certo número de electróns,
cos que conseguir a configuración de gas nobre, que necesitan.
Un primeiro modelo interesante para entender como se
poden compartir electróns para conseguir configuración de gas nobre é o
modelo das estruturas de Lewis.
Este modelo, para explicar a ligazón covalente, foi
proposto por Gilbert Newton Lewis en 1916. Segundo este modelo os
átomos aproxímanse ata solapar as súas capas electrónicas, de forma que
os átomos cando se enlazan comparten pares de electróns. Estes
pares de electróns que se comparten denomínanse pares enlazantes.
Pero tamén podemos ter pares de electróns sen compartir sobre algúns
átomos, que chamaremos pares non enlazantes. Nestas estruturas
observamos que, cando se enlazan, os átomos conseguen ter catro pares de
electróns ao redor dos mesmos, é dicir, conseguen completar o octeto,
conseguen configuración de gas nobre.
No
tema
de enlace de 4º de ESO xa vimos como construir estas
estruturas de Lewis para moléculas sinxelas.
| Molécula |
Estrutura de Lewis |
| H2 |
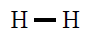 |
| F2 |
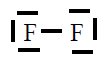 |
| Cl2 |
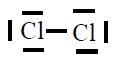 |
| O2 |
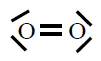 |
| N2 |
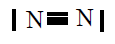 |
| HF |
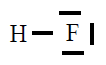 |
| HCl |
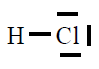 |
| H2O |
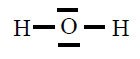 |
| NH3 |
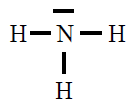 |
| CH4 |
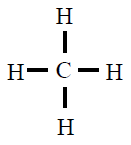 |
| HCN |
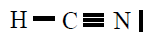 |
| CO2 |
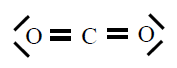 |
En todas observamos que os átomos están rodeados de 4
pares de electróns, configuración de gas nobre, excepto o H que está
rodeado dun par, configuración de gas nobre para o hidróxeno.
Para construír estruturas máis complexas podemos seguir
as normas seguintes:
1º Elixir o átomo central. Adoita ser o menos electronegativo
ou o que máis electróns necesita para conseguir estrutura de gas nobre.
2º Calcular os electróns de valencia necesarios, EN, para que
os átomos cumpran coa regra do octeto. Contaranse 8e− por
cada átomo, coas seguintes excepcións:2e− para o H, 4e−
para o Be, 6e− para o B. Os elementos a partir do terceiro
período poden ter "octetos expandidos", se son necesarios sumaranse ao
número de electróns de valencia o número de ligazóns formadas, se non dá
menos de 8, para obter os electróns necesarios, EN.
3º Calcular os electróns de valencia dispoñibles, ED.
Sumaranse os electróns de valencia de todos os átomos da molécula, e
teranse en conta tamén as cargas dos ións, nas cargas negativas súmanse
electróns, nas positivas réstanse.
4º Calcular os pares enlazantes, PE. Aos electróns necesarios,
EN, restámoslle os electróns dispoñibles, ED, dándonos os electróns que
se deben compartir. Dividindo por 2 obtemos os pares de enlace, PE:
5º Calcular os pares non enlazantes, PN. Os electróns
dispoñibles, ED, menos os electróns que forman pares de ligazón, 2·PE,
dannos os electróns que non enlazan nada, que non contribúen á ligazón.
Dividindo por 2 obtemos os pares non enlazantes, PN:
Por exemplo, calcula a estrutura de Lewis para o ozono, O3:
Que estrutura podemos propoñer para o ozono
segundo a TRPECV?
Vexamos cal é a estrutura real do ozono:
Estrutura do ozono (Wikipedia).
Se contamos os electróns que asignamos a cada átomo na
estrutura, con respecto aos electróns de valencia que debería ter,
podemos calcular a carga formal sobre cada átomo.
Para contar os electróns sobre cada átomo contaremos un
por cada par de enlace e dous por cada par non enlazante.
Se o número de electróns ao redor do átomo é maior que o
número de electróns de valencia hai exceso de electróns. A carga formal
será negativa e igual ao número de electróns en exceso.
Se o número de electróns ao redor do átomo é menor que o
número de electróns de valencia hai defecto de electróns. A carga formal
será positiva e igual ao número de electróns en defecto.
Se o número de electróns ao redor do átomo é igual ao
número de electróns de valencia non hai nin exceso nin defecto de
electróns. A carga formal será cero.
A suma de todas as cargas formais debe ser igual á carga
total do composto.
Se podemos propoñer varias estruturas para un
composto será máis probable a que presente menores cargas formais sobre
os seus átomos.
Sábese que na molécula de ozono os enlaces son iguais,
pero na estrutura de Lewis proposta os enlaces son diferentes, un
sinxelo e outro dobre. Unha solución a este problema é propoñer máis
dunha estrutura posible para unha substancia, estruturas que chamaremos
estruturas resonantes. A estrutura real será unha mestura entre
as estruturas resonantes, que chamaremos híbrido de resonancia.
Hai átomos nalgúns compostos que non teñen electróns
suficientes para completar o octeto, como lle pasa ao B no BF3.
Outros compostos teñen átomos que poden presentar máis
de catro enlaces, dise que teñen o octeto expandido. Son átomos
que dispoñen de orbitais d que tamén poden utilizar na formación de
enlaces, como lle ocorre ao S no SF6, e a outro elementos do
terceiro período e superiores.
TRPECV significa Teoría de repulsión dos pares
electrónicos da capa de valencia. Este modelo tenta explicar a
xeometría das moléculas a partir das estruturas de Lewis. Predí a
xeometría molecular e os ángulos de enlace supoñendo que os pares
electrónicos, xa sexan de enlace como non enlazantes, débense dispoñer
nunha xeometría que minimice as forzas repulsivas entre os mesmos. Para
determinar a estrutura, os enlaces dobres e triples, contan coma se
fosen sinxelos.
| Pares electrónicos |
Disposición dos pares |
Ángulos |
Exemplos |
| 2 |
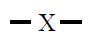
Lineal
|
180º |
BeF2
CO2
|
| 3 |
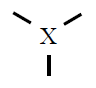
Trigonal plana
|
120º |
BF3
SO3
|
| 4 |
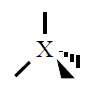
Tetraédica
|
109º |
CH4, NH3,
H2O |
| 5 |
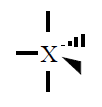
Bipiramidal trigonal
|
120º y 90º |
PCl5 |
| 6 |
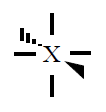
Octaédrica
|
90º |
SF6 |
Constrúe moléculas e observa a súa xeometría
utilizando esta simulación da Universidade de Colorado:
En MODELO, podes construír moléculas engadindo pares de
enlace e pares non enlazantes ao átomo central. Tamén podes eliminar
pares. Podes mostrar os ángulos de enlace, observa como varían os
ángulos de enlace en función do número de pares. Tamén che dá o nome da
xeometría de pares e da xeometría molecular. En MOLÉCULAS
REAIS tes algúns exemplos de moléculas. Alternando entre a estrutura
real e o modelo podes observar o efecto que producen os pares non
enlazantes sobre a xeometría molecular.
EXERCICIOS
PARA PRACTICAR
 |
|
ENLACE COVALENTE. POLARIDADE
DOS ENLACES
|
|
Cando dous átomos iguais únense mediante un enlace
covalente os dous átomos atraen igualmente aos electróns do enlace. O
centro da carga positiva e negativa na molécula é o mesmo. Isto pasa no
H2, N2, ou Cl2.
Pero que ocorre se os átomos unidos por unha ligazón
covalente son distintos, como ocorre por exemplo no HCl. Se dous átomos
distintos únense por un enlace covalente sempre un atraerá máis os
electróns do enlace que o outro. O átomo máis electronegativo atraerá
máis aos electróns do enlace producindo unha separación de cargas. Sobre
o cloro haberá una certa carga parcial negativa e sobre o hidróxeno una
certa carga parcial positiva, xa que o cloro é máis electronegativo que
o hidróxeno. Esta separación de cargas creará un momento dipolar de
enlace .
O momento dipolar é un vector que vén dado polo produto
da carga efectiva sobre cada átomo e a distancia que as separa. O
sentido deste vector apunta cara ao átomo máis electronegativo.
Unha molécula é polar se cumpre dúas
condicións:
1º Se ten enlaces polares, é dicir, se ten
enlaces entre átomos distintos, e
2º se estes dipolos non se anulan por simetría.
A molécula de auga, presenta ligazóns
polares e como é angular estes dipolos de ligazón non se anulan por
simetría,
senón que se suman vectorialmente para dar un vector
momento dipolar total distinto de cero. O H2O é unha molécula
polar.
A molécula de CO2, tamén
presenta enlaces polares, pero estes anúlanse por simetría, de forma que
o momento dipolar total é cero. O CO2 é unha molécula
apolar.
Como sabemos que dipolos de enlace se anulan por
simetría? Depende do número de enlaces iguais que rodeen a un átomo
central e dos ángulos que formen. Telos nesta táboa:
|
ANÚLANSE
POR SIMETRÍA OS SEGUINTES DIPOLOS DE ENLACE |
| Dipolos de enlace iguaIs |
Disposición dos dipolos
de enlace |
Ángulos |
| 2 |
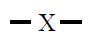
Lineal
|
180º |
| 3 |
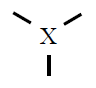
Trigonal plana
|
120º |
| 4 |
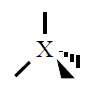
Tetraédica
|
109º |
| 5 |
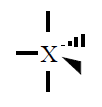
Bipiramidal trigonal
|
120º y 90º |
| 6 |
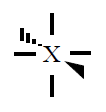
Octaédrica
|
90º |
EXERCICIOS
PARA PRACTICAR
 |
|
ENLACE
COVALENTE.
PROPIEDADES DOS COMPOSTOS COVALENTES |
|
As substancias covalentes poden ser
moléculas ou cristais covalentes, é dicir, redes cristalinas onde todas
as ligazóns son covalentes. Dependendo de cada tipo de substancia
teremos diferentes propiedades:
|
PROPIEDADES DAS
SUSTANCIAS COVALENTES MOLECULARES |
| Propiedade |
Característica |
Por
que? |
| Estrutura |
Moléculas dun determinado número
de átomos |
Os átomos comparten electróns dando
lugar a ligazóns covalentes que os unen formando agregados que
chamamos moléculas. |
| Estado
físico |
Gas, líquido ou sólido |
As moléculas máis pequenas adoitan
dar lugar a gases a non ser que as interaccións intermoleculares
sexan grandes. |
| Puntos de
fusión e ebulición |
Baixos |
En xeral as forzas entre moléculas
son débiles. |
| Dureza |
Brandas |
Debido ás débiles forzas
intermaleculares. |
| Solubilidade |
As substancias polares disólvense en
disolventes polares, como a auga, e as substancias apolares
disólvense disolventes apolares. |
A solubilidade depende da polaridade
das moléculas, as polares disólvense en disolventes polares e as
apolares en disolventes apolares. |
| Condutividade
eléctrica |
En xeral non son condutoras |
Os electróns dos enlaces están
localizados e carecen de cargas que se poidan desprazar. |
| Exemplos |
Auga, H2O |
 |
|
Sacarosa, C12H22O11
(azucre de mesa) |
 |
|
Sofre, S |
 |
| Outros: O2, N2,
CH4, C6H12O6,
CH3CH2OH |
|
PROPIEDADES DAS
SUSTANCIAS COVALENTES CRISTALINAS |
| Propiedade |
Característica |
Por
que? |
| Estrutura |
Redes cristalinas covalentes |
Os átomos comparten electróns dando
lugar a estruturas cristalinas formadas por enlaces covalentes |
| Estado
físico |
Sólido |
Debido á fortaleza dos enlaces
covalentes, custa moito rompelos |
| Puntos de
fusión e ebulición |
Moi altos |
A interacción entre os átomos na
rede é moi forte |
| Dureza |
Moi duras |
Son as substancias máis duras que
coñecemos debido á fortaleza dos enlaces que as forman |
| Solubilidade |
Insolubles |
Os disolventes non son capaces de
romper os enlaces covalentes que as forman |
| Conductividade
eléctrica |
En xeral non son condutoras, aínda
que o grafito si é condutor |
Os electróns dos enlaces están
localizados e carecen de cargas que se poidan desprazar. Aínda que
algunhas si presentan condutividade como o grafito. |
| Exemplos |
Cuarzo, SiO2 |
 |
|
Silex, rocha que contén sílice SiO2,
moi apreciada na prehistoria para a fabricación de útiles de pedra. |
 |
| Outros exemplos: C(grafito), C(diamante), carborundo SiC |
Se sodes afeccionados aos minerais
saberedes que están formados por substancias cristalinas iónicas ou
covalentes. Observa este vídeo para saber como se forman na natureza os
cristais destes minerais:
EXERCICIOS
PARA PRACTICAR

|
|
ENLACE METÁLICO. MODELO
DO GAS ELECTRÓNICO |
|
Enlace metálico: dáse entre átomos metálicos. Son
todos sólidos coa excepción do mercurio que é líquido a temperatura
ambiente. Presentan índices de coordinación moi altos, frecuentemente
12, é dicir, cada átomo metálico rodéase a unha distancia mínima doutros
doce átomos metálicos. 6 nun plano, 3 sobre ese plano, e 3 máis por
baixo do plano, nunha estrutura que se denomina hexagonal compacta.
Estruturas das redes metálicas: Podemos distinguir nos metais tres redes
de diferente estrutura:
- Rede cúbica centrada no corpo (CC). Por exemplo: ferro
alfa, vanadio, cromo, titanio, molibdeno, wolframio.
- Rede cúbica centrada nas caras (CCC). Por exemplo: ferro
gamma, cobre, aluminio, ouro, prata, chumbo, níquel.
- Rede hexagonal compacta (HC). Por exemplo: magnesio,
cinc, cadmio.
As diferenzas entre estas estruturas pódelas atopar nestes
vídeos:
Os metais caracterízanse por ter estruturas moi
compactas e altas densidades, os seus átomos deben estar moi xuntos.
Entre as súas propiedades características están a alta condutividade
eléctrica e condutividade térmica. Dado que os electróns de
valencia dos metais pódense mover con facilidade duns átomos a outros,
debido aos seus baixos potenciais de ionización. Podemos supoñer un
modelo no que os átomos se distribúen en estruturas cristalinas
compactas e os electróns de valencia desprázanse entre eles con
facilidade, é o que se denomina o modelo do gas electrónico, ou
do mar de electróns.
Se illamos os electróns de valencia, nos átomos
metálicos, o restos que queda é un catión metálico, por iso ao
representar este modelo debúxase unha estrutura de ións metálicos
positivos, entre a que se moven os electróns de valencia. Pero hai que
ter coidado con esta representación, pois non existen tales ións, lembra
que para que haxa un ión positivo, que perde electróns, ten que haber
ións negativos, que os gañen, como ocorre nos compostos iónicos. Os
electróns que se moven na rede cristalina sempre están en contacto cos
átomos metálicos, de forma que non hai tales ións, só é unha forma de
representar o átomo, debuxando a nube de electróns de valencia e o resto
do átomo.
Este modelo tamén explica as propiedades de
ductilidade, facilidade para formar fíos, e maleabilidade,
facilidade para formar láminas moi finas, que presentan os metais. Ao
non haber repulsiones, nin ligazóns fortes que haxa que romper entre os
átomos, o gas electrónico que os envolve favorece o seu desprazamento
entre os mesmos.
Lembra que aínda que ás veces represéntese este modelo
como unha estrutura de cationes metálicos rodeados dun mar de electróns,
non existen propiamente estes cationes, non é un modelo iónico, tampouco
o é covalente, compartindo os electróns con átomos próximos. En todo
caso debemos de entender que todos os átomos metálicos comparten, entre
todos, os seus electróns de valencia.

|
|
ENLACE
METÁLICO.
PROPIEDADES DOS COMPOSTOS METÁLICOS |
|
PROPIEDADES DAS
SUSTANCIAS METÁLICAS |
| Propiedade |
Característica |
Por
que? |
| Estrutura |
Redes cristalinas metálicas |
Os átomos metálicos forman
estruturas moi compactas con altos índices de coordinación |
| Estado
físico |
Sólido (o Hg é líquido) |
Os altos índices de coordinación fan
que estas estruturas sexan sólidas. |
| Puntos de
fusión e ebulición |
Medios e altos |
Hai metais que funden facilmente
como Sn ou Pb e outros que só o fan a altísimas temperaturas como W
ou Os |
| Dureza |
Variable |
Algúns son moi brandos como o Na que
se corta con coitelo, ou o Pb, e outros presentan gran dureza
dependendo da fortaleza da ligazón. En xeral son dúctiles e
maleables. |
| Solubilidade |
Insolubles en auga, pero solubles
noutros metais formando aliaxes, e en Hg formando amálgamas. Tamén
moitos se disolven ben en ácidos. |
As moléculas de auga non os disolven
pero os ácidos oxidan moitos átomos metálicos a cationes que así
pasan á disolución. |
| Condutividade
eléctrica |
Son moi bós condutores |
Os electróns libres da rede
cristalina favorecen a condutividade eléctrica e térmica dos metais. |
| Exemplos |
Ouro, Au. |
 |
|
Mercurio, Hg, único metal líquido a
temperatura ambiente |
 |
|
Aluminio, Al; Ferro, Fe; Latón,
aliaxe de Cu e Zn. |
 |
Déixovos aquí uns vídeos interesantes sobre dous metais
curiosos. Un o mercurio, Hg, o único metal líquido a temperatura
ambiente. Outro o wolframio, W, dos metais máis densos que existen.
EXERCICIOS
PARA PRACTICAR
 |
|
FORZAS INTERMOLECULARES |
|
Xa vimos que as substancias covalentes moleculares
podían presentarse nos tres estados: sólido, liquido e gas. Que aparezan
nun ou outro estado depende das interaccións entre moléculas. Estas
interaccións entre moléculas son un tipo de ligazón que chamaremos
enlaces débiles, ou forzas intermoleculares, para
diferencialos dos enlaces fortes: iónico, covalente e metálico.
Estas ligazóns entre moléculas poden ser de dous tipos:
Forzas de Van der Waals e enlaces de hidróxeno.
- As forzas de Van der Waals poden ser de varios tipos:
- Forzas de dispersión de London, ou forzas dipolo instantáneo
- dipolo inducido.
- Forzas dipolo - dipolo inducido, ou forzas de Debye.
- Forzas dipolo - dipolo, ou forzas de Keesom.
As forzas de dispersión de London, ou forzas dipolo
instantáneo - dipolo inducido, xustifican os puntos de ebulición
máis altos do esperable para moléculas apolares como, N2, O2,
ou os gases nobres. Estas moléculas apolares non debesen interaccionar,
pero nalgunha delas pódense producir dipolos instantáneos. Ao moverse os
electróns dentro da molécula, nalgún momento, pode haber máis densidade
electrónica nunha partes que noutras da molécula. Estes dipolos
instantáneos, que terán unha duración moi curta, inducen nas que están
próximas dipolos inducidos, estes dipolos formados interaccionan en
breves intervalos de tempo, aumentando os puntos de ebulición. Nos
instantes posteriores estes dipolos desaparecen, as moléculas volverán
ser apolares, polo que estas interaccións son moi débiles.
As forzas dipolo - dipolo inducido, ou forzas de
Debye, teñen lugar ao interaccionar moléculas polares con moléculas
apolares, como o H2O (polar) co CO2 (apolar).
As forzas dipolo - dipolo, ou forzas de Keesom, son as máis
intensas das tres, as dúas moléculas deben de ser polares. É o caso de
interacción entre moléculas de HCl, por exemplo.
- O enlace de hidróxeno, ou enlace por pontes de
hidróxeno, prodúcese en moléculas que conteñen átomos de pequeno
tamaño, moi electronegativos e con pares non enlazantes, como o F, O
e N, unidos a átomos de hidróxeno, como ocorre no HF, H2O
e NH3.
As moléculas de auga presentan ligazóns polares O-H,
podemos representar unha certa carga parcial negativa sobre o osíxeno e
unha certa carga parcial positiva sobre o hidróxeno. Estas cargas
parciais e os pares non enlazantes sobre o osíxeno, permiten pensar que
se debilita a ligazón entre o osíxeno e os hidróxenos da molécula, e
créase unha ligazón parcial entre o osíxeno dunha molécula e os
hidróxenos doutras, de forma que os hidróxenos fan de ponte entre dous
átomos de osíxeno, creándose unhas ligazóns parciais, que deben ter unha
compoñente covalente, como propuxo Pauling, e recentemente demostrouse.
Estas interaccións estarían entre as forzas de Van der Waals e as
ligazóns covalentes. Os enlaces de hidróxeno tamén son os responsables
da estrutura de moitas proteínas (seda, seda de araña, queratina),
polisacáridos estruturais (celulosa, quitina), e algúns polímeros
sintéticos (poliamidas).
Nas moléculas de ADN os enlaces de hidróxeno son os
responsables dos emparellamentos entre Timina-Adenina e
Citosina-Guanina, nos que se forman 2 e 3 enlaces de hidróxeno
respectivamente.
A interacción por enlace de hidróxeno é moito máis forte
que as interaccións dipolo-dipolo. O enlace de hidróxeno é a
xustificación dos altos puntos de ebulición do HF, H2O e NH3
fronte aos demais compostos de hidróxeno dos seus grupos, nos que as
interaccións son dipolo - dipolo. Observa o seguinte gráfico que nos
representa os puntos de ebulición dos compostos de hidróxeno.
En los compuestos de hidrógeno de los elementos del grupo del carbono
observamos que el punto de ebullición aumenta de una forma, más o menos
lineal desde el C al Sn, estas son moléculas apolares, pero más
polarizables al aumentar el tamaño del átomo central.
Podríamos esperar un comportamiento similar en los demás grupos, que
aunque presentan moléculas polares, vemos que siguen esta misma
variación del punto de ebullición, con la excepción de tres compuestos,
el NH3, el HF y el H2O.
En estos tres compuestos el punto de ebullición es notablemente mayor
que el que se esperaría de comportarse como los demás compuestos de su
grupo. ¿Qué ocurre entonces? Pues que debe haber una interacción entre
las moléculas, en este caso, mayor que la que se explicaría por las
fuerzas de Van der Waals. El enlace de hidrógeno, o enlace por puentes
de hidrógeno, es la interacción que justifica estos altos puntos de
ebullición. El nitrógeno, flúor y oxígeno que forman estos compuestos
tienen unas características que los diferencian de los demás, son átomos
pequeños, electronegativos y con pares no enlazantes. Cuando estén
unidos al hidrógeno pueden presentar enlaces por puente de hidrógeno.
Fíjate que el cloro no forma parte de este selecto grupo, al ser del
tercer período y ser más voluminoso. El carbono tampoco, no es tan
electronegativo, y no presenta pares no enlazantes.
Observa en el gráfico que el H2O, si la interacción que
presentara entre las moléculas fuera similar a las de los compañeros de
grupo, es decir, interacción dipolo-dipolo, su punto de ebullición
debería ser de unos -80ºC. Muy por debajo del real de 100ºC. Eso
significaría que el agua debería ser gas a cualquier temperatura que se
da en la Tierra, o dicho de otro modo, no habría agua líquida en la
Tierra, y por tanto no habría vida en nuestro planeta, por lo menos vida
como la que conocemos. La vida, por tanto, tiene que estar muy
agradecida a los enlaces de hidrógeno, y no solo a los del agua, sino a los
que se dan en otras moléculas como ácidos nucleicos o proteínas, también
moléculas muy ligadas a la vida. No estaría mal hacerle un monumento a
los enlaces por puente de hidrógeno, ¿no te parece?
Nos compostos de hidróxeno dos elementos do grupo do
carbono observamos que o punto de ebulición aumenta dunha forma, máis ou
menos lineal dende o C ao Sn, estas son moléculas apolares, pero máis
polarizables ao aumentar o tamaño do átomo central.
Poderiamos esperar un comportamento similar nos demais
grupos, que aínda que presentan moléculas polares, vemos que seguen esta
mesma variación do punto de ebulición, coa excepción de tres compostos,
o NH3, o HF e o H2O.
Nestes tres compostos o punto de ebulición é
notablemente maior que o que se esperaría de comportarse como os demais
compostos do seu grupo. Que ocorre entón? Pois que debe haber unha
interacción entre as moléculas, neste caso, maior que a que se
explicaría polas forzas de Van der Waals. O enlace de hidróxeno, ou
enlace por pontes de hidróxeno, é a interacción que xustifica estes
altos puntos de ebulición. O nitróxeno, flúor e osíxeno que forman estes
compostos teñen unhas características que os diferencian dos demais, son
átomos pequenos, electronegativos e con pares non enlazantes. Cando
estean unidos ao hidróxeno poden presentar enlaces por ponte de
hidróxeno. Fíxate que o cloro non forma parte deste selecto grupo, ao
ser do terceiro período e ser máis voluminoso. O carbono tampouco, non é
tan electronegativo, e non presenta pares non enlazantes.
Observa no gráfico que o H2O, se a
interacción que presentase entre as moléculas fose similar ás dos
compañeiros de grupo, é dicir, interacción dipolo-dipolo, o seu punto de
ebulición debería ser duns -80ºC. Moi por baixo do real de 100ºC. Iso
significaría que a auga debería ser gas a calquera temperatura que se dá
na Terra, ou dito doutro xeito, non habería auga líquida na Terra, e por
tanto non habería vida no noso planeta, polo menos vida como a que
coñecemos. A vida, por tanto, ten que estar moi agradecida ós enlaces de
hidróxeno, e non só aos da auga, senón aos que se dan noutras moléculas
como acedos nucleicos ou proteínas, tamén moléculas moi ligadas á vida.
Non estaría mal facerlle un monumento ás ligazóns por ponte de
hidróxeno, non che parece?
EXERCICIOS
PARA PRACTICAR

|
|
FORMULACIÓN INORGÁNICA |
|
 |
  |
|
