 
|
|
|
|
INTRODUCCIÓN HISTÓRICA
|
En culturas antigas como Babilonia e Exipto
algunhas das substancias que actualmente coñecemos co nome de ácidos
empregábanse xa na metalurgia, na produción de tinguiduras e no curtido
das peles de animais.
Os alquimistas usaron ácidos como disolventes dos metais, paso
previo para transmutarlos en ouro. Tamén empregaron certas augas
ardentes ou álcalis (do árabe "al kali" = "cinzas vexetais") cáusticos
que hoxe denominamos hidróxidos ou bases (do grego "basis" =
"fundamento" para a obtención de sales).
No século XVII, o químico inglés Robert Boyle (1627-1691)
realizou a primeira descrición sistemática das propiedades dos ácidos:
a) Disolven gran cantidade de substancias.
b) Arroiban algúns pigmentos vexetais de cor azul.
c) Perden as súas propiedades ao poñelos en contacto con bases.
Lavoisier (1743-1794),
no seu "Tratado elemental de Química", sistematizou todas as propiedades
anteriores e desenvolveu unha primeira teoría sobre estas substancias,
considerando que as súas propiedades eran debidas á existencia de
osíxeno na súa composición (ácido nítrico, ácido sulfúrico, etc.)
Humphry Davy (1778-1829)
demostrou que o cloruro de hidróxeno non posuía osíxeno na súa
composición e presentaba claras propiedades ácidas, así como outras
substancias (HBr, HI, HCN, etc.). Estes feitos levaron a considerar que
era a presenza de hidróxeno, en lugar do osíxeno, na composición das
substancias, a responsable de que presentase propiedades ácidas,
consideración que quedou establecida definitivamente por
Justus von Liebig (1803-1873),
que chegou á conclusión de que nas reaccións dos ácidos cos metais,
estes desprazan ao hidróxeno dos ácidos formando os sales.
Michael Faraday (1791-1867)
descubriu en 1834 a condutividade eléctrica das disolucións acuosas de
ácidos e bases.

|
|
TEORÍA DE ARRHENIUS
|
|
As substancias que en disolución acuosa conducen a corrente
eléctrica chámanse electrólitos.
Svante August Arrhenius (1859-1927)
foi o primeiro que estableceu a hipótese da disociación iónica, dando
solución teórica ao enigma da condución eléctrica das disolucións
acuosas de substancias como os ácidos, as bases e os sales, fronte ao
comportamento das demais substancias (non electrolitos) en disolución
acuosa. Esta teoría da disociación iónica recoñecéuselle en 1903 co Nobel
de química. Arrhenius considerou que os electrolitos en
contacto coa auga parten a súa molécula en dous corpúsculos materiais
cargados eléctricamente, aos que chamou ións. Segundo a súa
teoría, no medio acuoso os ácidos se disocian en ións positivos (H+
, protóns) e ións negativos (anións).
A disociación en ións do ácido clorhídrico pode expresarse mediante
a ecuación química:
En realidade, os ións H+ nunca se atopan
libres en disolución acuosa, senón unidos a varias moléculas de H2O.
A partir de agora representaremos un protón en disolución acuosa pola
especie H3O+ , que denominaremos ión
oxonio.
Para o ácido sulfúrico, ou ácido das baterías de chumbo
dos coches:
Este último proceso (ácidos polipróticos = ácidos con
varios hidróxenos transferibles) prodúcese en dúas etapas:
que de forma global está representada na ecuación anterior.
As bases se disocian en ións positivos (catións) e ións
negativos (OH−, hidróxido) segundo ecuacións como:
A disociación iónica dos sales produce ións positivos,
como nas bases, e ións negativos, como nos ácidos, como vemos nestes
casos:
Estes ións ou partículas cargadas son os vehículos da
condución eléctrica nas disolucións de electrolitos; as demais
substancias, ao non producir ións en disolución, non son condutoras da
electricidade.
Por tanto, ácidos son as substancias que en disolución acuosa se
disocian producindo ións H3O+. E bases son as
substancias que en disolución acuosa se disocian producindo ións OH−.
Reacción de neutralización.
Se o ión H+ é o causante das propiedades
ácidas e o ión OH− o é das propiedades básicas, a reacción de
neutralización entre un ácido e unha base debe implicar a eliminación
dos ións H+ e OH−. A única maneira de que isto
ocorra é reaccionando entre se para dar auga. É dicir,
A reacción global entre un ácido e unha base é:
Por exemplo a reacción de neutralización entre o ácido
clorhídrico e o hidróxido de sodio é:
Dificultades da teoría de Arrhenius.
A teoría de Arrhenius dos ácidos e bases só se pode
aplicar en disolucións acuosas; con todo, hai casos nos que se observan
propiedades ácido-base en medios non acuosos, por exemplo a reacción
É unha reacción de neutralización na que o HCl
compórtase como ácido e o NH3 como base, sen que interveñan
ións H3O+ e OH−.
Existen moitas substancias distintas dos ácidos e bases de
Arrhenius que teñen propiedades ácidas e básicas como o amoníaco, os
óxidos metálicos, o ión cloruro, os carbonatos e moitas outras que non
encaixan nesta teoría.

|
|
TEORÍA DE
BRÖNSTED-LOWRY
|
|
Para dar resposta ás dificultades da teoría de Arrhenius,
o químico danés
Johannes Nicolaus
Brönsted (189-1947) e o inglés Thomas Lowry (1874-1936)
propuxeron en 1923 unha nova teoría de ácidos e bases. Esta engloba
todos os aspectos da teoría de Arrhenius, elimina a necesidade dunha
solución acuosa e amplía as substancias que poden considerarse acedas e
básicas.
Segundo Brönsted e Lowry: ácidos son as substancias
(moleculares ou iónicas) que poden ceder ións H+:
Bases son as substancias (moleculares ou iónicas) que
poden aceptar ións H+:
Son ácidos de Brönsted-Lowry:
-
moléculas como: HCl, HNO3, H2SO4, H3PO4,
H2O
-
catións como: NH4+ , H3O+
-
anións como: HCO3−, HSO4−,
H2PO4−, HS−
Amplíase a gama de substancias ácidas a outros compostos
moleculares e sobre todo a especies iónicas.
Son bases de Brönsted-Lowry:
-
moléculas como: NH3, H2O, CH3NH2
-
anións como: I−, Br−, CO32−,
HSO4−, OH−
-
catións como: [Cu(H2O)3OH]+
Tamén aquí se amplía a lista de bases respecto a a de
Arrhenius.
Ácidos e bases conxugados.
Na teoría de Brönsted e Lowry resulta fundamental o
concepto de ácidos e bases conxugados. Cando un ácido cede un protón
fórmase un anión negativo que terá a capacidade de capturar un protón
para rexenerar o ácido. O anión, neste caso, compórtase como unha base.
Observamos este comportamento no ácido clorhídrico e no ión amonio
(ambos ácidos de Brönsted-Lowry)
O mesmo razoamento pódese facer cunha base. Entón
podemos concluír que: Todos os ácidos ao ceder un protón producen as
bases conxugadas dos devanditos ácidos, e todas as bases que captan un
protón producen ácidos conxugados das bases.
Como os ións H+ non existen libres as propiedades dos
ácidos e bases de Brönsted-Lowry póñense de manifesto ao interaccionar
un ácido e unha base entre si para dar as respectivas bases e ácidos
conxugados:
As reaccións entre ácidos e bases son reaccións de
transferencia de protóns. Se temos un ácido necesitamos unha base para
que capte o protón. Se temos unha base necesitamos un ácido para que lle
ceda un protón. O ácido convértese na base conxugada e a base no ácido
conxugado.
Reacción de neutralización.
A reacción de neutralización entre un ácido e unha base
explícase mediante a reacción
Nesta teoría as substancias consideradas ácidas na
teoría de Arrhenius continúan sendo ácidas, pero faise evidente que para
que o ácido se manifeste fai falta a presenza dunha base. Ademais,
permite considerar como reaccións ácido-base reaccións que non
transcorren no medio acuoso.
Exemplos:
a) Reacción en fase gasosa:
b) Reacción de neutralización en amoníaco líquido:
Substancias anfóteras ou anfipróticas.
Algunhas substancias, como o caso da auga, poden actuar
como aceptoras ou donadoras de ións H+ e, por tanto, como
bases ou ácidos de Brönsted:
Estas substancias chámanse anfóteras ou anfipróticas.
Outras substancias como:
H2PO4−, HPO42−, HS− ou
HSO4−, procedentes da disociación parcial de
ácidos de Arrhenius tamén presentan as mesmas propiedades:
EXEMPLO 1: Identifica as seguintes especies químicas como
ácidos ou bases de Brönsted-Lowry cando reaccionan con
H2O: a) F− , b) NH4+ , c)
H2PO4−. Escribe as reaccións
indicando a natureza de cada substancia.
SOLUCIÓN
EXERCICIOS
PARA PRACTICAR

|
|
TEORÍA DE LEWIS
|
|
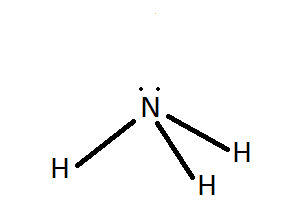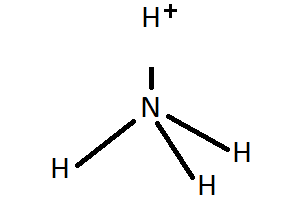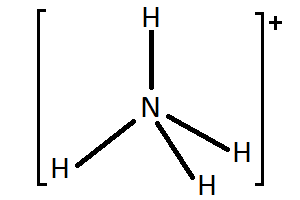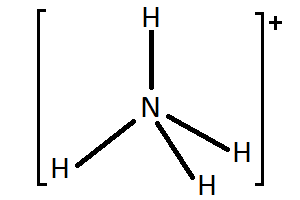
Ao estudar Gilbert N. Lewis (1875-1946)
a distribución dos electróns nas moléculas dos ácidos e das bases deuse
conta de que a reacción de neutralización requiría a formación dun
enlace covalente coordinado (enlace no que os dous electróns do enlace
son achegados polo mesmo átomo).
O OH− posúe pares de electróns sen compartir
que son susceptibles de ser doados a átomos con orbitais baleiros de
baixa enerxía, como o H+.
Deste xeito, de acordo coa teoría de Lewis, un ácido é
toda substancia que pode aceptar un par de electróns e unha base é toda
substancia que pode ceder un par de electróns para formar un enlace
covalente coordinado.
Outros exemplos de enlace covalente coordinado son o enlace entre
os protóns e as moléculas de auga e amoníaco, nos que estas ceden un par
non enlazante para formar o enlace co protón.
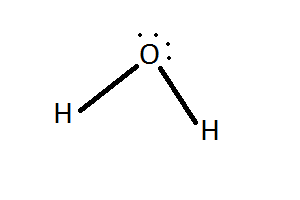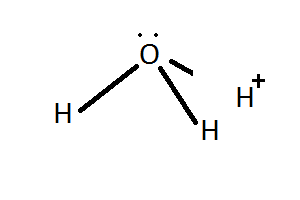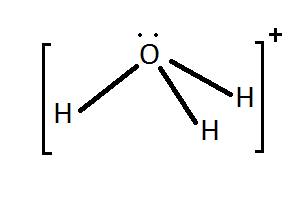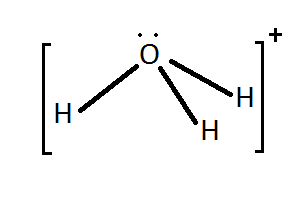 |
|
H2O + H+
⇄ H3O+ |
 |
|
NH3 + H+
⇄ NH4+ |
Esta definición inclúe aos ácidos e bases das teorías de
Arrhenius e Brönsted-Lowry, ademais doutras reaccións que teñen lugar no
medio non acuoso e sen transferencia protónica. Por exemplo:
Cadro comparativo das teorías ácido-base
| TEORÍA |
Arrhenius
(teoría ións en auga) |
Brönsted-Lowry
(teoría protónica) |
Lewis
(teoría electrónica) |
| Definición de ácido |
Da ións H+ en auga. |
Dador de protóns. |
Aceptor par electrónico. |
| Definición de base |
Da ións OH− en auga. |
Aceptor de protóns. |
Doador par electrónico. |
| Reaccións ácido-base |
Formación de auga |
Transferencia protónica. |
Formación de enlace covalente coordinado. |
| Ecuación química |
 |
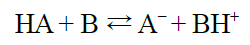 |
 |
| Limitacións |
Aplicable unicamente a disolucións acuosas |
Aplicable unicamente a reaccións de
transferencia protónica |
Teoría xeral |

|
|
FORZA DE ÁCIDOS E BASES
|
Segundo a teoría de Brönsted e Lowry, a forza relativa dos
ácidos e das bases depende da súa maior ou menor tendencia a ceder ou
aceptar ións H+.
As disolucións dos ácidos e bases son equilibrios químicos para os
que os valores das súas constantes de equilibrio Ka e Kb
(constantes de disociación para un ácido e unha base) representan unha
medida cuantitativa da súa fortaleza. Empecemos por un ácido que todos
temos nas nosas casas, o ácido acético ou ácido etanoico, CH3COOH,
coñecido por ser o compoñente esencial do vinagre.
A lei de acción de masas permítenos calcular a constante
de equilibrio
pero como a concentración de H2O líquida é sempre a mesma, é
constante, pódese pasar ao primeiro membro e englobala xunto coa
constante de equilibrio, K, co que se obtén a que denominamos constante
de acidez, Ka.
Para o amoníaco, NH3, base de Brönsted que
tamén podemos atopar facilmente nas nosas casas ou no súper, pódese
facer o mesmo, ata obter a que denominamos constante de basicidade, Kb.
do que se obtén
Valores de Ka e Kb moito maiores que
a unidade representan concentracións das formas iónicas grandes, e
valores moito menores que a unidade o contrario (pequena disociación).
Teoricamente considéranse ácidos e bases fortes aqueles que están
totalmente disociados en disolucións esluídas. De forma que a
concentración das formas moleculares tendería a ser nula e os valores de
Ka e Kb infinitamente grandes.
En realidade, para os ácidos e bases fortes en disolución acuosa
non poden determinarse con exactitude os valores de Ka e Kb
polo efecto nivelador da auga. Por exemplo, o HClO4 ácido
perclórico é un ácido máis forte que o HCl ácido clorhídrico, ambos
están completamente disociados na auga e parece, por tanto, que teñen a
mesma forza. A este fenómeno denomínaselle efecto nivelador do
disolvente. En auga a forza de ambos ácidos redúcese á do ácido H3O+(aq)
O ácido máis forte que pode existir nun
disolvente dado é o ácido conxugado do disolvente. Así, en NH3(l)
a forza de todos os ácidos redúcese á forza do ácido NH4+
, ión amonio. Do mesmo xeito, a base máis forte que pode existir nunha
disolución dada é a base conxugada do disolvente. Na auga, a base máis
forte é o ión OH− e en amoníaco líquido a base máis forte é o
ión NH2−, ión azanuro.
Ácidos e bases débiles son os que están disociados parcialmente e
neles coexisten no equilibrio as formas iónicas e moleculares.
Nos ácidos e bases débiles defínese o grao de disociación α
como o cociente de moléculas disociadas respecto a as moléculas iniciais
do ácido ou da base, e pódese expresar en tanto por un ou en tanto por
cen.
Canto máis pequeno sexa o grao de disociación, menos moléculas
disociadas haberá respecto ás moléculas iniciais e máis débil será o
ácido ou a base. O grao de disociación é α=100% ou α=1 nos ácidos e
bases fortes. Se o grao de disociación é α=5% significa que de cada 100
moléculas iniciais de ácido ou de base só están disociadas no equilibrio
5.
Os valores de Ka poden establecer unha clasificación
aproximada dos ácidos segundo:
| Valores de Ka |
Ka > 55 |
55 > Ka > 10−4 |
10−4 > Ka >
10−14 |
Ka<10−14 |
| Forza do ácido |
Forte |
Intermedio |
Débil |
Moi débil |
Podemos citar como ácidos fortes os seguintes ácidos:
perclórico, yodhídrico, bromhídrico, sulfúrico, clorhídrico, nítrico e
clórico:
Na seguinte táboa danse valores de Ka para
outros ácidos menos fortes:
| Ácido |
Ka |
| HIO3 |
1,9·10−1 |
| H2SO3 |
1,7·10−2 |
| HClO2 |
1,1·10−2 |
| HF |
7,4·10−4 |
| H2CO3 |
3,0·10−7 |
| HClO |
1,1·10−8 |
| HBrO |
2,5·10−9 |
| HIO |
4,5·10−13 |
Para parellas ácido-base conxugadas de Brönsted-Lowry, se
un ácido é forte a base conxugada é moi débil, e viceversa:
A relación entre Ka e Kb é unha
relación inversa para un ácido e a súa base conxugada como se observa na
táboa:
| Ácido forte |
Ka |
Kb |
Base débil |
| HClO4 |
moi grande |
moi pequena |
ClO4− |
| HCl |
moi grande |
moi pequena |
Cl− |
| HNO3 |
moi grande |
moi pequena |
NO3− |
| H2SO4 |
moi grande |
moi pequena |
HSO4− |
| H3O+ |
1,00 |
1,0·10−14 |
H2O |
| HSO4− |
1,3·10−2 |
7,69·10−13 |
SO42− |
| H2SO3 |
1,7·10−2 |
5,9·10−13 |
HSO3− |
| H3PO4 |
7,5·10−3 |
1,33·10−12 |
H2PO4− |
| CH3COOH |
1,8·10−5 |
1,45·10−11 |
CH3COO− |
| HSO3− |
1,02·10−7 |
9,8·10−8 |
SO32− |
| H2CO3 |
4,3·10−7 |
2,32·10−8 |
HCO3− |
| H2S |
9,1·10−8 |
1,1·10−7 |
HS− |
| HCN |
4,9·10−10 |
2,04·10−5 |
CN− |
| NH4+ |
5,6·10−10 |
1,78·10−5 |
NH3 |
| HS− |
1,1·10−12 |
9,1·10−3 |
S2− |
| H2O |
1,8·10−16 |
moi grande |
OH− |
| NH3 |
moi pequena |
moi grande |
NH2− |
| OH− |
moi pequena |
moi grande |
O2− |
| Ácido débil |
Ka |
Kb |
Base forte |
Tamén tes unha táboa de constantes de acidez e basicidade
nas TÁBOAS
DE QUÍMICA.
EXEMPLO 2: Nunha disolución 0,050M dun ácido HA monoprótico
determínase que a concentración de H3O+ na
disolución é 4·10−5M. Calcula o valor da constante de
ionización do ácido.
SOLUCIÓN
EXEMPLO 3: Calcula o grao de disociación e a concentración das
especies presentes no equilibrio nunha disolución de ácido acético, CH3COOH,
0,25M. A constante de disociación do ácido é Ka = 1,8·10−5
SOLUCIÓN
EXEMPLO 4: Calcula o grao de disociación e a concentración das
especies presentes no equilibrio nunha disolución de amoníaco, NH3,
0,40M. A constante de disociación do amoníaco é Kb = 1,79·10−5
SOLUCIÓN
EXERCICIOS
PARA PRACTICAR

|
|
ÁCIDOS POLIPRÓTICOS
|
|
Os ácidos poden ter un, dous ou tres hidróxenos que poden
ceder nunha reacción ácido base. Os ácidos con dous ou tres hidróxenos
ácidos denominámolos ácidos polipróticos. A forza dos ácidos non depende
do número de protóns que cedan:
Os ácidos polipróticos non ceden á vez, e con igual
facilidade, todos os protóns. O ácido sulfhídrico presenta dúas
disociacións, condicionadas polas constantes K1 e K2.
K1 é moito maior que K2, polo que
practicamente todos os ións H+ que fornece a disociación de H2S
proceden da primeira disociación de H2S.
No ácido fosfórico prodúcense tres disociacións:
En xeral, en todos os ácidos polipróticos prodúcense
disociacións graduais con constantes de disociación que van diminuíndo a
medida que se ceden máis hidróxenos. Observa que na primeira disociación
separamos unha carga +1 dunha carga −1, na segunda disociación
separamos unha carga +1 dunha carga −2, e na terceira disociación
separamos unha carga +1 dunha carga −3, canto maiores sexan as
cargas máis custará separalas.

|
|
IONIZACIÓN DA AUGA
|
|
Na auga prodúcese un equilibrio de disociación no que unhas
moléculas compórtanse como ácidos e outras como bases formando ións
hidróxido OH− e ións oxonio H3O+:
Como calquera equilibrio este proceso virá regulado por
unha constante de equilibrio:
e xa que a concentración da auga sen disociar pode
considerarse practicamente constante,
pódese pasar ao primeiro membro e englobala na constante
de equilibrio:
Esta nova constante que resulta chamarémola produto
iónico da auga e represéntase por
Kw.
Esta expresión do produto iónico da auga, que a 25ºC ten o
valor de 1·10−14, indica que o produto das concentracións dos
ións oxonio e hidróxido na auga pura é unha constante a cada
temperatura.
Esta relación existente entre os ións H3O+
e OH− non só se cumpre na auga, senón en calquera disolución
acuosa dun ácido e unha base, e permite relacionar tamén os valores das
constantes Ka (disociación dun ácido) e Kb
(disociación da base conxugada) en calquera par ácido-base conxugado.
Sexa un ácido monoprótico débil de fórmula xeral HA e a súa base
conxugada A−. As disociacións en auga pódense expresar
mediante as ecuacións
As expresións de Ka e Kb son:
se multiplicamos Ka por Kb
obtemos:
Esta relación permite calcular Ka coñecida Kb,
ou viceversa, por iso é polo que nas táboas de forza relativa de pares
ácido-base conxugados soamente ponse un dos dous valores, normalmente o
de Ka.
Esta expresión será de gran utilidade para coñecer as
constantes de acidez ou basicidade de especies iónicas.
EXEMPLO 5: A constante de ionización do ácido
hipocloroso, HClO, é 3,2·10−8. Calcula o valor de Kb
da súa base conxugada. Formula as reaccións de ionización desta e do
ácido HClO e escribe as expresións dos seus constantes de ionización.
SOLUCIÓN
EXERCICIOS
PARA PRACTICAR

|
|
DISOLUCIÓNS ÁCIDAS, BÁSICAS E NEUTRAS
|
|
Dado que a auga é neutra e por cada ión oxonio debe haber un
ión hidróxido, as concentracións de ambos deben ser iguais:
Tendo en cuenta o valor do produto iónico da auga
de onde deducimos que:
o que indica que a condición que se cumpre nas
disolucións neutras é:
Se a unha disolución neutra de auga engadímoslle unha
pequena cantidade de ácido, aumentamos a concentración de ións oxonio, H3O+,
e debido a que o produto iónico da auga, Kw, debe manterse
constante, o equilibrio
evolucionará no sentido en que se consuman ións hidróxido,
OH−, diminuíndo a súa concentración.
Nas disolucións ácidas cumprirase que
No caso de que á disolución neutra de auga engadámoslle
unha pequena cantidade de base, aumentamos a concentración de ións
hidróxido, OH−, e polo razoamento anterior concluímos que
debe diminuír a concentración de ións oxonio,
H3O+.
Nas disoluciones básicas cumprirase que

|
|
CONCEPTO DE pH
|
|
O pH ou índice de hidróxeno dunha disolución
defínese como o logaritmo do inverso da concentración de ións oxonio
contidos na mesma.
Nunha disolución neutra, [H3O+] =
10−7M, terá un pH = 7
Unha disolución ácida con [H3O+] >
10−7, dará un pH < 7, por exemplo se [H3O+] =
10−5M implica que pH = 5
Unha disolución básica con [H3O+] <
10−7, dará un pH > 7, por exemplo se [H3O+] =
10−9M implica que pH = 9
Do mesmo xeito, defínese o concepto de pOH como o
logaritmo do inverso da concentración de ións hidróxido contidos nunha
disolución.
Tomando logaritmos na expresión do produto iónico da agua,
Mudando o signo
podemos escribir entón
O pH e pOH resultan moi útiles para establecer de maneira
rápida a acidez e basicidade dunha disolución. En realidade o pH e o pOH
non nos achegan máis información que as concentracións de ións oxonio ou
de ións hidróxido, pero resulta máis cómodo traballar con números máis
sinxelos que con potencias de dez tan baixas.
Na seguinte simulación, en MACRO podes comprobar o pH de
diferentes disolucións. Comproba como varía o pH cando varías a
concentración das disolucións. En MICRO observa como varían as
concentracións de ións oxonio e hidróxido nas diferentes disolucións. En
MI SOLUCIÓN podes modificar as concentracións dos ións oxonio e
hidróxido e observar a variación de pH das mesmas.
SIMULACIÓN
UNIVERSIDADE DE COLORADO: ACIDEZ E BASICIDADE DE SUBSTANCIAS

|
|
CÁLCULO DO pH DE DISOLUCIÓNS DE ÁCIDOS
E BASES
|
|
Un ácido considérase forte se a súa constante de
disociación Ka é moi elevada. Neste caso pódese considerar
que a reacción de transferencia protónica é total, é dicir, o ácido está
totalmente disociado. A concentración de H3O+ se
calcula facilmente a partir da concentración inicial do ácido.
EXEMPLO 6: Calcula o pH dunha disolución 0,1M de HCl.
SOLUCIÓN
Se a constante de equilibrio Ka é pequena o
ácido é débil. As concentracións das especies que interveñen están
relacionadas pola expresión da constante de equilibrio.
Para calcular o pH debemos coñecer a concentración de ións
oxonio no equilibrio, e para isto debemos calcular as concentracións de
todas as especies químicas que interveñen no equilibrio coñecida a
constante de acidez, Ka, a unha temperatura dada.
Para estimar [H3O+] fanse dúas aproximacións:
1) Suponse despreciable a cantidade de H3O+
achegada pola disociación da auga. Isto é razoable xa que a [H3O+]
dada pola disociación da auga non pode ser maior que 10−7 mol/l.
Esta aproximación é válida sempre que o valor de Ka non sexa
da orde de Kw.
Supoñamos o equilibrio para un ácido débil monoprótico:
As concentracións no equilibrio están relacionadas coa
constante de acidez, Ka.
2) Ao ser un ácido débil e a constante moi pequena o
equilibrio estará moi desprazado cara aos reactivos, é dicir, teremos
moito ácido sen disociar e pouco ácido disociado, Por tanto podemos
desprezar a cantidade de ácido disociado, x, fronte á cantidade de ácido
inicial, C. Esta aproximación é válida só se C >> Ka. Desta forma, [HA]
≈ C
Coas dúas aproximacións anteriores obtense a relación:
que nos permite calcular a concentración de ións oxonio de forma
sinxela.
Para as bases séguese o mesmo razoamento, só que falaremos de Kb
no canto de Ka.
EXEMPLO 7: Calcula o pH dunha disolución 0,10M de ácido acético.
Ka=1,8·10−5
SOLUCIÓN
EXEMPLO 8: Calcula o pH dunha disolución 3,0·10−3M de
Ba(OH)2
SOLUCIÓN
EXEMPLO 9: Calcula o pH dunha disolución 0,10M de NH3.
Kb=1,79·10−5
SOLUCIÓN
Na seguinte simulación, en INTRODUCCIÓN podes comprobar
o pH de diferentes disolucións de ácidos e bases segundo a súa
fortaleza. Podes usar o pH-metro, papel indicador ou un circuíto de
condutividade. En MI SOLUCIÓN podes modificar o carácter débil ou forte
das disolucións.
SIMULACIÓN
UNIVERSIDADE DE COLORADO: DISOLUCIÓNS DE ÁCIDOS E BASES
SIMULACIÓN
LABORATORIO VIRTUAL, SALVADOR HURTADO: pHmetro
EXERCICIOS
PARA PRACTICAR

|
|
PROPIEDADES ÁCIDO-BASE DAS DISOLUCIÓNS DE SALES. HIDRÓLISE
|
As disolucións de sales poden dar disolucións ácidas, básicas
ou neutras. Como podemos coñecer a acidez ou basicidade dunha disolución
dun sal? Para iso debemos disociar o sal e coñecer como se comportan os
ións do sal fronte á auga. Se un ión provén dun ácido forte, será a súa
base conxugada, e será extremadamente débil, tanto que non dá reacción
fronte á auga. Lembra que canto máis forte é un ácido máis débil será a
súa base conxugada. O mesmo pasa con ións que proveñan de bases fortes,
serán ácidos conxugados tan extremadamente débiles que non reaccionan
coa auga.
Pero se un ión provén dun ácido débil, non será unha base conxugada
tan débil que non poida dar reacción coa auga. Ou se provén dunha base
débil non será un ácido conxugado tan débil que non poida dar reacción
coa auga. Lembra que a constante de acidez (Ka) dun ácido
débil está relacionada coa constante de basicidade (Kb) da
súa base conxugada, a través do produto iónico da auga (Kw),
e a constante de basicidade (Kb) dunha base débil está
relacionada coa constante de acidez (Ka) do seu ácido
conxugado, a través do produto iónico da auga (Kw): Kw
= Ka · Kb = 10−14
Que casos pódensenos presentar:
- Disolución dun sal de ácido forte e base forte
A disolución acuosa dun sal como o NaCl, que provén dun
ácido forte e unha base forte, é neutra. Isto explícase facilmente se se
considera que as reaccións
teñen lugar nunha extensión despreciable, xa que o ión Cl− é
unha base extremadamente débil (o seu ácido conxugado, HCl, é moi forte)
e o catión Na(H2O)n+ é un ácido
extremadamente débil, pois provén dunha base moi forte, o NaOH. En
consecuencia, o pH da disolución non se modifica polas reaccións
anteriores e é o mesmo que o da auga pura, é dicir, 7, a 25ºC.
- Disolución dun sal de ácido débil e base forte
Unha disolución acuosa de acetato de sodio, CH3COONa,
ou NaAc, sal que provén dun ácido débil, o ácido acético, HAc, e unha
base forte, o hidróxido de sodio, NaOH, ten carácter básico. Como o
ácido acético é débil, a súa base conxugada, o ión Ac−, non
será tan extremadamente débil e dará reacción con auga, capta protóns da
auga dando lugar a ións OH− segundo a reacción:
Os ións OH− confiren á disolución carácter
básico. Esta reacción tamén se denomina reacción de hidrólise,
que non é máis que un tipo de reacción acedo-base de Brönsted-Lowry.
A reacción do catión Na(H2O)n+ coa
auga practicamente non ten lugar, polo que non se achegan ións H3O+.
O efecto neto é que a disolución acuosa adquire carácter básico.
A constante de equilibrio da reacción do ión acetato coa auga vén
dada pola expresión:
onde Kb é a constante de basicidade do ión
acetato, tamén denominada constante de hidrólise.
A constante Kb pode calcularse facilmente a partir da
constante de acidez Ka do ácido conxugado HAc. Multiplicando
o numerador e o denominador da expresión anterior por [H3O+]
teremos:
Chegando a esta expresión xa coñecida:
Podemos calcular a constante de basicidade dun ión a
partir da constante de acidez do ácido do que provén e do produto iónico
de auga. Estas constantes telas nas TÁBOAS
DE QUÍMICA.
EXEMPLO 10: Calcula o pH dunha disolución 0,10 M de CH3COONa.
Dato: Ka(CH3COOH) = 1,8·10−5
SOLUCIÓN
- Disolución dun sal de ácido forte e base débil
Unha disolución acuosa de cloruro de amonio, NH4Cl,
sal que provén dun ácido forte, o ácido clorhídrico, HCl, e unha base
débil, o amoníaco, NH3, ten carácter ácido. Anteriormente
díxose que o ión cloruro, Cl−, é unha base extremadamente
débil e por tanto non achegaba ións OH− á disolución. Como o
amoníaco, NH3, é unha base débil, o seu ácido conxugado, o
ión amonio, NH4+, non será extremadamente débil, e
cede protóns á auga segundo a reacción:
A formación de H3O+ explica o
carácter ácido da disolución.
A constante de equilibrio da reacción anterior é:
Onde Ka é a constante de acidez do ión NH4+.
Ka pode calcularse facilmente a partir da constante de
disociación básica Kb da base conxugada correspondente, NH3.
Multiplicando numerador e denominador da expresión anterior por [OH−],
teremos:
Co que chegamos á coñecida expresión:
EXEMPLO 11: Calcula o pH dunha disolución 0,10 M de NH4Cl.
Dato: Kb(NH3) = 1,79·10−5
SOLUCIÓN
- Disolución dun sal de ácido débil e base débil
Nunha disolución acuosa dun sal que provén dun ácido débil
e dunha base débil, teñen lugar dúas reaccións que afectan ao pH. Por
exemplo, nunha disolución de acetato de amonio, CH3COONH4,
ou NH4Ac, teñen lugar os dous equilibrios seguintes:
Neste caso, o cálculo do pH da disolución é máis complexo
que nos casos anteriores, xa que hanse considerar simultaneamente ambos
equilibrios.
Se as constantes Kb e Ka das reaccións
anteriores son parecidas, o pH da disolución estará enormemente próximo
a 7, é dicir, a disolución é practicamente neutra.
EXERCICIOS
PARA PRACTICAR

|
|
DISOLUCIÓNS REGULADORAS OU AMORTECEDORAS
|
As disolucións que están formadas por ácidos débiles e un dos
seus sales (cun catión que proveña dunha base forte) ou bases débiles e
un dos seus sales (cun anión que proveña dun ácido forte), denomínanse
disolucións reguladoras ou amortecedoras.
Estas disolucións son case máxicas, presentan gran resistencia a
variar a concentración de ións H3O+, e por tanto o
pH, incluso engadindo pequenas cantidades de ácido ou de base, que sobre
a auga pura modificarían varias unidades o pH da mesma. Podemos engadir
pequenas cantidades de ácidos ou bases ás mesmas sen que o pH apenas
varíe.
As disolucións amortecedoras teñen aplicación en procesos de
análise química nos que se precisen condicións constantes de pH, e gran
importancia nos procesos bioquímicos dos organismos vivos. O sangue
presenta un pH de 7,4 e variacións de pH de 0,4 unidades supoñen
alteracións que producirían a morte. Outros líquidos biolóxicos de
animais e vexetais presentan tamén sistemas amortecedores da acidez
para regular as concentracións de ións minerais e proteínas.
Como se produce a acción amortecedora? Consideremos un ácido
débil, como o ácido acético, disociado nos seus ións acetato e oxonio.
Este equilibrio está moi desprazado cara aos reactivos, se
eliminamos ións oxonio o equilibrio reponos, pero se engadimos ións
oxonio o equilibrio non os pode consumir pois temos poucos ións acetato.
Engadiremos ións acetato, a través dun sal soluble, para que o
equilibrio poida desprazarse nos dous sentidos, cara aos reactivos ou
cara aos produtos, cando engadimos pequenas cantidades de ácido ou de
base.
Ao engadir acetato de sodio ao ácido acético, o ión acetato aumenta
a súa concentración no equilibrio:
Este aumento da concentración de ión acetato fai que se
desprace o equilibrio de disociación do ácido acético cara a esquerda
(principio de Le Chatelier) co fin de facer diminuír a concentración de
ión acetato. Este feito coñécese como efecto de ión común e é a causa da
acción amortecedora da disolución.
Se agora engadimos unha certa cantidade de ácido, aumenta a
cantidade de ión oxonio, H3O+ , nunha proporción
grande pero a existencia de ión acetato do sal fai que unido ao oxonio
produza acético molecular ata alcanzar as novas concentracións do
equilibrio de disociación do ácido acético, dacordo coa súa constante Ka.
Con iso diminúe a proporción de H3O+ e, por tanto,
a variación do pH da disolución é moito menor que a que se produciría
sobre a auga pura.
Se se engade unha base, o ácido acético se disocia en
maior proporción neutralizando boa parte dos ións OH− a
expensas do H3O+ cedido polo ácido, co que se
eliminan gran parte dos OH− e, por tanto, a variación do pH
da disolución é moito menor que a que se produciría sobre a auga pura.
- Cálculo do pH dunha disolución reguladora
Calculemos o pH dunha disolución reguladora formada por
mestura dun ácido débil HA de concentración Ca e a súa base
conxugada A− de concentración Csal (que provén do
sal NaA).
Teremos o seguinte equilibrio:
A constante Ka regula as concentracións no
equilibrio:
Para calcular o pH despexamos a concentración de ións
oxonio:
Podemos aplicar logaritmos e cambiar o signo para calcular
o pH:
Ao engadir o anión do sal o equilibrio desprázase cara aos
reactivos, e por tanto podemos facer unhas aproximacións:
Para unha disolución reguladora básica, por exemplo, NH3(aq)
+ NH4Cl a expresión é moi similar:
Da que deducimos o pH:
Non fai falta aprender estas expresións de memoria, é
mellor expor o equilibrio e calcular a partir del as concentracións de H3O+
ou de OH−, e a partir delas o pH.
EXEMPLO 12: Cal é o pH dunha disolución 0,200M de ácido nitroso,
HNO2, e 0,050M de nitrito de sodio? Para o HNO2, Ka=4,5·10−4.
SOLUCIÓN
EXEMPLO 13: Cal é o pH dunha disolución que é 0,030M en
NH3(aq) e 0,070M en NH4NO3?; Kb=1,8·10−5 para el
NH3(aq).
SOLUCIÓN
- Estudio da acción reguladora
A capacidade de resistir as variacións de pH debidas á
adición de bases fortes ou de ácidos fortes que presentan as disolucións
reguladoras débese a que conteñen protóns en reserva, en forma de ácido
débil, que poden anular a acción da base e que conteñen unha reserva de
base, en forma de anión, que pode reaccionar cos protóns engadidos por
un ácido forte. É esta posibilidade de desprazar o equilibrio nos dous
sentidos o que permite a acción reguladora destas reaccións.
EXEMPLO 14: Unha disolución é 0,200M en ácido acético e 0,200M
en acetato de sodio. (a) Cal é o seu pH? Que cambio de pH prodúcese ao
engadir a un litro desta disolución 0,050 moles (b) de HCl e (c) de NaOH?
(Ignórense os cambios de volume). (d) Cal sería o pH de engadir estas
cantidades a un litro de auga destilada?
SOLUCIÓN
PRÁCTICA: Na seguinte práctica podes observar o comportamento
dunha disolución reguladora fronte á adición dunha disolución ácida.
EXERCICIOS
PARA PRACTICAR

|
|
INDICADORES ÁCIDO-BASE
|
|
Os indicadores son substancias, xeralmente orgánicas, de
carácter ácido ou básico débil, que teñen a propiedade de cambiar de cor
ao variar o pH entre valores ben determinados. Cada indicador cambia de
cor en distinto intervalo de pH, podéndose cubrir case toda a escala de
1 a 14.
Para que un indicador sexa útil debe cambiar bruscamente
de cor nun intervalo pequeno de pH, entre 2 ou 3 unidades de pH.
O cambio de cor dos indicadores débese á distinta
coloración que ofrecen a forma molecular (HIn) e a forma iónica (In−)
do mesmo. Nos indicadores existe un equilibrio entre ambas as formas,
predominando unha ou outra segundo a concentración dos ións oxonio
(H3O+) que presente o sistema.
Para un indicador que se disocia como un ácido débil
(algún é debilmente básico), a ecuación que representa este equilibrio
será:
Se engadimos un ácido ao sistema aumentamos a
concentración de ións oxonio, entón o equilibrio desprazarase cara á
esquerda, predominará a forma molecular do indicador, HIn, e presentará
a coloración propia desta.
Se, pola contra, engadimos unha base ao sistema diminuímos a
concentración de ións oxonio, por adición de ións hidróxido, o
equilibrio desprazarase cara á dereita, predominará a forma iónica do
indicador, In−, e, consecuentemente, aparecerá o seu
coloración propia.
|
INDICADORES DE pH |
| Indicador |
Intervalo de viraxe (pH) |
Cambio de cor
de ácido a base |
| Laranxa de metilo |
3,1 - 4,6 |
laranxa - amarelo |
| Verde de bromocresol |
3,8 - 5,4 |
amarelo - azul |
| Vermello Congo |
3,0 - 5,0 |
azul - vermello |
| Vermello de metilo |
4,8 - 6,0 |
vermello - amarelo |
| Tornasol |
5 - 8 |
vermello - azul |
| Azul de bromotimol |
6,0 - 7,6 |
amarelo - azul |
| Vermello de fenol |
6,6 - 8,0 |
amarelo - vermello |
| Fenolftaleína |
8,2 - 10,0 |
incoloro - vermello |
| Timolftaleína |
9,4 - 10,6 |
incoloro - azul |
Tamén tes unha táboa de indicadores nas TÁBOAS
DE QUÍMICA.

|
|
VALORACIÓN ÁCIDO-BASE
|
|
As reaccións de neutralización son as que teñen lugar entre
un ácido e unha base, dando como produtos a auga e o sal correspondente:
En realidade, o proceso de neutralización consiste na
reacción entre o ión oxonio procedente do ácido e o ión hidróxido
procedente da base para dar auga, xa que o sal está completamente
disociada nos seus ións:
ou máis propiamente
Estas reaccións podémolas utilizar para determinar a
concentración dun ácido a partir dunha disolución de base de
concentración coñecida, mediante volumetrías de neutralización, que se
dividen en acidimetrías e alcalimetrías, segundo que a substancia que se
analice sexa un ácido ou unha base.
Ao final de calquera neutralización sempre se cumpre que:
Para a reacción xenérica:
Cúmprese que:
Onde nº H é o número de H+ do ácido e nº OH é o
número de OH− da base.
Esta fórmula é de aplicación xeral en todos os procesos
volumétricos.
O problema dunha valoración consiste en determinar o punto de
equivalencia, situación na cal o número de protóns do ácido coincide
co número de hidróxidos da base. Para o que é preciso coñecer o pH no
punto de equivalencia, co fin de escoller un indicador que vire ao redor
deste pH. Ao momento correspondente ao cambio de cor nunha valoración
denomínaselle punto final, xa que é entón cando o indicador
sinala que a valoración terminou. A cantidade de indicador que se
utiliza debe ser pequena, porque pola contra consumiríase parte da base
ou do ácido para valorar.
A variación de pH na proximidade do punto de equivalencia, nalgúns
casos é tan brusca que se pode utilizar sen erro apreciable un indicador
cun intervalo de viraxe que non coincida co pH do punto de equivalencia.
Noutros casos, pola contra, a variación de pH non é tan acusada e é
necesario coñecer a curva de valoración, é dicir, a curva que se obtén
ao representar gráficamente o pH da disolución para valorar fronte ao
volume de reactivo engadido, para decidir o indicador máis conveniente.
PRÁCTICA: Podes ver unha valoración ácido-base na
seguinte práctica. Trátase de determinar a concentración dun ácido forte,
de concentración descoñecida, a partir dunha disolución dunha base forte
de concentración coñecida.
- Curva de valoración dun ácido forte cunha base forte
Consideraremos a valoración de 50 ml dunha disolución de
HCl 0,10M cunha disolución de NaOH 0,10M.
Veremos cal é o cambio que experimenta o pH da disolución
para valorar durante a adición da disolución de NaOH. Evidentemente esta
valoración non é necesaria para determinar a concentración de HCl que xa
se coñece, pero serve de modelo para observar a variación de pH durante
a valoración.
Construímos unha táboa cos valores do pH da mestura de ambas as
disolucións despois de engadir volumes de base que van desde 0 ata
100mL.
a) Cálculo do pH inicial:
b) Cálculo do pH, antes do punto de equivalencia, despois
de engadir un volume Va de disolución de NaOH, onde:
- n(H3O+) = moles de H3O+ en exceso
- no(H3O+) = moles iniciais de H3O+
- na(OH−) = moles de OH−
engadidos
- V = volume total de disolución
- Vo(H3O+) = volume inicial de HCl
- Va(OH−) = volume engadido de disolución NaOH
c) Cálculo do pH no punto de equivalencia: Cando levan
engadidos 50 ml de disolución de NaOH, os moles de ácido e os moles de
base engadidos son iguais, polo que se alcanzou o punto de equivalencia.
Neste momento temos unha disolución de NaCl en auga
d) Cálculo do pH despois do punto de equivalencia:
A táboa que se obtén é a seguinte:
| Volume en ml de NaOH
engadido |
pH |
| 0,0 |
1,00 |
| 10,0 |
1,18 |
| 25,0 |
1,48 |
| 40,0 |
1,95 |
| 49,0 |
3,00 |
| 49,9 |
4,00 |
| 50,0 |
7,00 |
| 50,1 |
10,00 |
| 51,0 |
11,00 |
| 60,0 |
11,96 |
| 75,0 |
12,30 |
| 100,0 |
12,52 |
Como pode observarse hai un gran cambio de pH nas
proximidades do punto de equivalencia, que se aprecia mellor na gráfica:
O brusco cambio de pH nas proximidades do punto de
equivalencia permite utilizar para detectalo calquera indicador que vire
entre pH=3 e pH=10; por exemplo, fenolftaleína, azul de bromotimol ou
laranxa de metilo. Por tanto, a non coincidencia do punto final co punto
de equivalencia non supón neste caso un erro apreciable.
Nesta simulación podes observar as curvas de valoración de
diferentes disolucións de ácidos e bases. Fíxate no brusco cambio de pH
no punto de equivalencia.
SIMULACIÓN
LABORATORIO VIRTUAL, SALVADOR HURTADO: CURVA DE VALORACIÓN ÁCIDO-BASE
Moi interesante esta simulación onde podes practicar
coas valoracións. Engade ao Erlenmeyer una certa cantidade de ácido,
logo engade o indicador, e por último realiza a valoración. Practica
para controlar a chave da bureta pasando o rato por encima. Xa sabes,
primeiro realiza un ensaio rápido para alcanzar o punto de equivalencia,
e logo realiza a determinación máis lenta nas proximidades do punto de
equivalencia. cos datos que obtés podes calcular as concentracións dos
ácidos.
SIMULACIÓN
LABORATORIO VIRTUAL, SALVADOR HURTADO: VALORACIÓN ÁCIDO-BASE
EXERCICIOS
PARA PRACTICAR

|
 
|
|
