O número de compostos orgánicos coñecidos (varios
millóns na actualidade) é moi superior ao de compostos inorgánicos, a
pesar de ser tan poucos os elementos que entran na súa composición. A
razón deste feito hai que buscala na capacidade que presenta o carbono
para combinarse facilmente consigo mesmo e con outros elementos mediante
enlaces covalentes.
A configuración electrónica do carbono é:
Esta configuración só permite a formación de dous
enlaces covalentes por solapamento de orbitais. Segundo a teoría de
Enlace de Valencia os orbitais que solapan para formar enlace deben ter
un único electrón. Se un átomo solapa un orbital con dous electróns, o
orbital co que solapa debe estar baleiro, formando o que se chama un
enlace dativo.
Sábese que o carbono é tetravalente, forma catro enlaces nas súas
combinacións. Temos que dar unha explicación a este feito. A explicación
é que dada a pouca diferenza de enerxía que hai entre os orbitais 2s e
os 2p é fácil promocionar un electrón 2s a un orbital 2p, obténdose a
seguinte configuración:
Esta configuración permite a formación de catro enlaces
covalentes por compartición de electróns, xa sexa consigo mesmo ou con
outros elementos, gáñase así con fartura a enerxía antes investida en
promocionar o electrón a un orbital superior.
De todos os xeitos esta configuración tampouco explica
as características do carbono nos seus compostos. Fixémonos no metano,
CH4, sábese que todas os seus enlaces son iguais. Se no
metano solaparan os orbitais 2s e 2p do carbono cos 1s de hidróxeno,
teriamos dous tipos de enlaces. Ademais sábese que a xeometría é
tetraédrica, pero se solaparan os orbitais 2p para formar os enlaces
estes formarían ángulos de 90º entre eles. Como explicar isto?
Para explicalo houbo que refinar o modelo de Enlace de
Valencia. Non sempre solapan orbitais atómicos puros cando se forman os
enlaces. A cada orbital atómico correspóndelle unha función de onda.
Estas funcións de onda pódense combinar linealmente para dar un conxunto
de orbitais híbridos. Un conxunto de orbitais atómicos que se combine
linealmente dará un conxunto do mesmo número de orbitais híbridos. Se se
combinan linealmente o orbital 2s e os tres orbitais 2p do carbono
teremos un conxunto de catro orbitais híbridos iguais, chamados sp3,
xa que todos están formados por unha parte de orbital s e tres partes de
orbital p. Son orbitais direccionales, de forma parecida aos orbitais p,
pero cun dos lóbulos moito maior que o outro, nos esquemas só pintaremos
o lóbulo maior.
O átomo de carbono pode combinar os seus orbitais 2s e
2p puros para dar un conxunto de catro orbitais híbridos sp3.
Os orbitais híbridos sp3 teñen unha
xeometría tetraédrica. Sempre que o carbono estea unido a catro átomos
empregará híbridos sp3. Os enlaces será de tipo σ xa
que o solapamento prodúcese na liña internuclear e a xeometría é
tetraédrica, con ángulos de 109º.
Isto é o que ocorre no metano, CH4. Os
orbitais híbridos sp3 solapan cos orbitais 1s do hidróxeno
para dar catro enlaces σ dando unha estrutura tetraédrica con
ángulos de 109º.
O mesmo ocorre no caso do etano, CH3−CH3.
Os orbitais híbridos sp3 dun carbono solapan co orbital
híbrido sp3 do outro carbono e cos orbitais 1s dos tres
hidróxenos para dar catro enlaces σ con estrutura tetraédrica e
ángulos de 109º. Esta xeometría será común a todos os alcanos.
Unha situación diferente ocorre no eteno, CH2=CH2,
o carbono está unido a tres átomos, un carbono e dous hidróxenos, e os
ángulos son de 120º. Esta xeometría é compatible con híbridos sp2,
que se forman por combinación lineal dun orbital 2s e dous orbitais 2p
do carbono.
Os orbitais sp2 forman unha
estrutura triangular plana con ángulos de 120º, e ao carbono
quédalle un orbital 2p puro perpendicular a esta estrutura. Estes
orbitais 2p puros dos dous carbonos poden solapar por encima e por
baixo do plano formado polos orbitais sp2. Este enlace
que solapa por encima e por baixo da liña internuclear denomínase
enlace π.
No eteno os carbonos utilizan híbridos sp2
para solapar cos orbitais 1s dos hidróxenos e sp2 do outro
carbono. Formando unha estrutura plana de enlaces σ, con ángulos
de 120º, cun orbital 2p sobre cada carbono que solapan entre si para
formar un enlace π. É a formación deste enlace π o que
mantén a estrutura plana de enlaces σ, xa que se os orbitais 2p
non están paralelos non poden solapar de forma eficaz. Esta estrutura
vai dar sempre que teñamos enlaces dobres nunha cadea carbonada.
No etino, CH≡CH, os catro átomos presentan unha
estrutura lineal, os enlaces do carbono, cun hidróxeno e co outro
carbono, forman un ángulo de 180º. Esta xeometría é compatible con
híbridos sp, que se forman por combinación lineal dun orbital 2s e
un orbital 2p do carbono.
Os orbitais sp forman unha estrutura lineal con
ángulos de 180º, e ao carbono quédanlle dous orbitais 2p puros
perpendiculares a esta estrutura lineal. Estes orbitais 2p puros dos
dous carbonos poden solapar por encima e por baixo da liña internuclear
e por diante e por detrás da mesma. Dando lugar a dous enlaces π.
En el etino los carbonos utilizan híbridos sp
para solapar con los orbitales 1s de los hidrógenos y sp del
otro carbono. Formando una estructura lineal de enlaces σ,
con ángulos de 180º, con dos orbitales 2p sobre cada carbono que solapan
entre sí para formar dos enlaces π.
No etino os carbonos utilizan híbridos sp para solapar cos orbitais
1s dos hidróxenos e sp do outro carbono. Formando unha estrutura lineal
de enlaces σ, con ángulos de 180º, con dous orbitais 2p sobre
cada carbono que solapan entre si para formar dous enlaces π.
EXERCICIOS
PARA PRACTICAR

|
Observa este interesante vídeo sobre os polímeros:
Os polímeros son macromoléculas formadas por
unión, mediante enlaces covalentes, de unidades simples chamadas
monómeros. Os polímeros teñen elevada masa molecular de polo menos
miles ou millóns de unidades de masa atómica.
As proteínas, o ADN e ARN, o amidón, a
celulosa, a seda, o caucho son exemplos de
polímeros naturais, e o celuloide, a baquelita, o
nailon, o poliéster e o polietileno de polímeros
sintéticos.
Os primeiros polímeros sintéticos obtivéronse por modificación de
polímeros naturais. En 1839 Charles Goodyear realiza o
vulcanizado do caucho. En 1870, John W. Hyatt sintetizou o
celuloide a partir de nitrato de celulosa.
O primeiro polímero totalmente sintético obtívose en 1909, cando o
químico belga Leo Hendrik Baekeland fabrica a baquelita a partir
de formaldehído e fenol. O poliestireno (PS) sintetízase en 1911 e o
poli(cloruro de vinilo) (PVC) en 1912.
En 1922, o químico alemán Hermann Staudinger
comeza o estudo dos polímeros e en 1926 expón a súa hipótese de que se
trata de longas cadeas de unidades pequenas unidas por enlaces
covalentes. Propuxo as fórmulas estruturais do poliestireno e do
polioximetileno, tal como coñecémolas actualmente, como cadeas
moleculares xigantes, formadas pola asociación mediante enlace covalente
de certos grupos atómicos chamados "unidades estruturais". Este concepto
converteuse en "fundamento" da química macromolecular só a partir de
1930, cando foi aceptado amplamente. En 1953 recibiu o Premio Nobel de
Química polo seu traballo.
Wallace Carothers, traballando na empresa DuPont
desde 1928, desenvolveu un gran número de novos polímeros: poliésteres,
poliamidas, neopreno etc.
A Segunda Guerra Mundial contribuíu ao avance na investigación de
polímeros. Por exemplo, foi moi importante a substitución do caucho
natural por caucho sintético.
- Clasificación dos polímeros segundo a súa composición:
HOMOPOLÍMEROS
Están formados por repetición dun único tipo de
monómero. Exemplo: polietileno (PE)
COPOLÍMEROS
Están formados por dous ou máis tipos de monómeros.
Exemplo: poliamida (PA)
- Clasificación dos polímeros segundo a súa estructura:
LINEAIS
Están formados por monómeros que se unen dando cadeas
lineais. Exemplo: poliestireno (PS)
RAMIFICADOS
Están formados por monómeros que se unen dando
estruturas ramificadas tridimensionais debido a que presentan monómeros
trifuncionais ou polifuncionais.
- Clasificación dos polímeros segundo o seu comportamento térmico:
TERMOPLÁSTICOS
Son polímeros que por quecemento vólvense deformables,
adquiren plasticidade. Pódense moldear pola acción da calor pero
vólvense ríxidos ao arrefriarse. Este proceso pode repetirse, en
principio, indefinidamente.
Posúen unha estrutura molecular de cadeas aberta ou fíos. Puntos de
fusión baixos. Solubles en disolventes orgánicos. Reciclables.
TERMOESTABLES
Son polímeros que unha vez formados non se poden moldear
ou fundir pola acción da calor. Obtéñense por condensación. Moldéanse
antes de que a reacción chegue ao seu fin.
Presentan estrutura entrecruzada. En xeral insolubles en
disolventes orgánicos. Descompóñense a elevada temperatura. Presentan
estruturas ríxidas debido ao gran entrecruzamiento molecular.
ELASTÓMEROS
Son polímeros que presentan propiedades elásticas. Pódense
estirar sen que rompan e recuperar a forma orixinal. Presentan
estruturas tridimensionais debilmente entrecruzadas. Presentan
semellanzas co caucho natural. Non son termoconformables.
- Clasificación dos polímeros segundo o seu método de obtención:
POLÍMEROS DE ADICIÓN
Son polímeros formados pola unión de moléculas
insaturadas, que rompen o seu enlace múltiple sen eliminación de
moléculas pequenas.
POLÍMEROS DE CONDENSACIÓN
Son polímeros formados pola unión de dous monómeros
difuncionais ou polifuncionais, que reaccionan entre si eliminando
moléculas de pequeno tamaño á parte do polímero.
- Reaccións de polimerización:
Reacción de polimerización por adición: Os polímeros de
adición están formados pola unión de moléculas sinxelas insaturadas, nos
que rompen os enlaces múltiples sen eliminación de moléculas pequenas. É
unha reacción en cadea que transcorre en tres etapas: iniciación,
propagación e terminación. O mecanismo pode ser por radicais libre ou
por ións.
Vexamos o mecanismo de adición por radicais libres:
Iniciación:
Os iniciadores da polimerización poden ser peróxidos
orgánicos que se descompoñen producindo radicais libres.
Propagación:
O radical libre ataca o dobre enlace do monómero,
xerando un novo radical libre que reacciona con novas moléculas de
monómero, incrementando a cadea do polímero.
Terminación:
Pódese producir por combinación de dous radicais libres:
Tamén pódese producir por desproporción ao transferirse
un átomo de hidróxeno dun radical a outro:
Reacción de polimerización por condensación: A condensación
prodúcese por reacción, de dous monómeros distintos, na que se xera
algunha molécula pequena tamén.
Por exemplo o PET ou polietilentereftalato é un
poliéster que se forma por condensación do etanodiol e o ácido 1,4-bencenodicarboxílico:
|
POLÍMEROS DE ADICIÓN |
| POLÍMERO
Nome tradicional
Abreviatura |
NOME IUPAC |
MONÓMERO |
ESTRUTURA |
| Polietileno PE |
Polieteno |
Eteno ou etileno |
 |
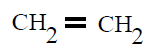 |
| Polipropileno PP |
Polipropeno |
propeno ou propileno |
 |
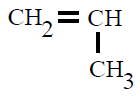 |
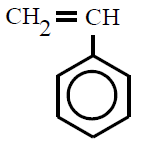
| Poliestireno PS |
Poli(etenilbenceno) |
etenilbenceno, vinilbenceno ou
estireno |
 |
 |
| Poli(cloruro de vinilo) PVC |
Poli(cloruro de vinilo) |
cloroeteno ou cloruro de
vinilo |
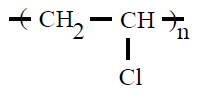 |
 |
| Poliacrilonitrilo PAN |
Poliacrilonitrilo |
propenonitrilo ou acrilonitrilo |
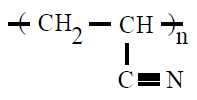 |
 |
| Poli(metacrilato de metilo) PMMA |
Poli(metacrilato de metilo) |
2-metilpropenoato de metilo ou
metacrilato de metilo |
 |
 |
| cis 1,4-polibutadieno PB |
Polibutadieno |
1,3 butadieno |
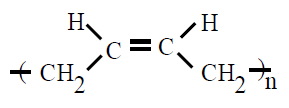 |
 |
CAUCHO:
O caucho é un polímero elástico, cis-1,4-polisopreno,
polímero do isopreno ou 2-metil-1,3-butadieno. Obtense como unha
emulsión leitosa (coñecida como látex) do zume de varias plantas, como a
Hevea brasiliensis. Outra planta que contén látex é o dente de león
común.
O caucho foi colleitado durante moito tempo xa antes da chegada dos
europeos, certos indíxenas do amazonas chamábano cautchouc, ou "árbore
que chora", e usárono para facer vasillas.
En 1839, por accidente, un inventor de Boston, Charles Goodyear
deixou caer unha mestura de caucho e de xofre sobre unha estufa quente.
Foi o principio da vulcanización, o proceso que fixo o caucho máis
resistente converténdoo en produto esencial da era industrial.
Actualmente fabrícanse multitude de artigos de caucho para
diferentes usos. O caucho é amplamente utilizado na fabricación de
pneumáticos, artigos impermeables e illantes, polas súas excelentes
propiedades de elasticidade e resistencia ante os ácidos e as
substancias alcalinas. É repelente á auga, illante da temperatura e da
electricidade.
POLIETILENO (PE):
O polietileno (PE) é químicamente o polímero máis
simple. É un dos plásticos máis comúns debido ao seu baixo prezo e
simplicidade na súa fabricación. É químicamente inerte. Obtense da
polimerización do eteno ou etileno CH2=CH2 , do
que deriva o seu nome.
O 27 de marzo de 1933, en Inglaterra, foi sintetizado tal como
coñecémolo hoxe en día, por Reginald Gibson e Eric Fawcett. Aplicando
moi altas presións e unha temperatura de 170 °C nun autoclave, obtiveron
o material de alta viscosidade e cor esbrancuxada que se coñece hoxe en
día como "polietileno de baixa densidade" (LDPE).
A altísima presión requirida era un inconveniente económico. Por
iso varios investigadores comezaron a buscar catalizadores que
permitisen a polimerización a presión máis reducida. Isto deu orixe aos
catalizadores Ziegler-Natta, polos cales Karl Ziegler e Giulio Natta
recibiron o premio Nobel de química en 1963. Os catalizadores clásicos
do tipo Ziegler-Natta son catalizadores mixtos que conteñen un composto
organometálico dos grupos principais I, II ou III do sistema periódico,
por exemplo trietilaluminio
Al(C2H5)3, e un composto dun metal de
transición, por exemplo tetracloruro de titanio TlCl4.
O polietileno de baixa densidade LDPE é un polímero cunha estrutura
de cadeas moi ramificadas; isto fai que teña unha densidade máis baixa
que a do HDPE (0,91-0,94 g/cm3).
Usos: Sacos e bolsas plásticas. Cubertas para invernadoiros e
outros usos agrícolas. Xoguetes. Obxectos de enxoval, como vasos, pratos,
cubertos. Botellas. Tubos e tubaxes.
O polietileno de alta densidade (HDPE) é un polímero que se
caracteriza por: excelente resistencia térmica e química, moi boa
resistencia ao impacto, é flexible, aínda a baixas temperaturas, é máis
ríxido que o polietileno de baixa densidade, é moi lixeiro e a súa
densidade atópase na contorna de 0,94-0,97 g/cm3.
Usos: Tubaxes para distribución de auga potable. Envases de
alimentos, deterxentes, e outros produtos químicos. Artigos para o fogar.
Xoguetes. Dispositivos protectores (cascos, xeonlleiras, ...).
POLICLORURO DE VINILO (PVC):
É un termoplástico que se obtén por polimerización do
cloruro de vinilo, ou cloroeteno. A resina que resulta desta
polimerización é a máis versátil da familia dos plásticos xa que a
partir dela pódense obter produtos ríxidos e flexibles.
É un plástico utilizado en áreas tan diversas como a construción,
enerxía, saúde, preservación de alimentos e artigos de uso diario, entre
outros.
O policloruro de vinilo foi descuberto por accidente polo menos en
dúas ocasións durante o século XIX: en 1835, por primeira vez, por Henri
Victor Regnault, e en 1872 por Eugen Baumann.
En 1926, Waldo Semon, en colaboración coa B. F. Goodrich Company,
desenvolveu un método de plastificación do PVC mediante a mestura con
aditivos que axudou a que o material fose máis flexible e máis fácil de
fabricar.
Ten unha elevada resistencia á abrasión, xunto cunha baixa
densidade (1,4 g/cm3), boa resistencia mecánica e ao impacto,
o que o fai común e ideal para a edificación e construción.
É un material altamente resistente, os produtos de PVC poden durar
ata máis de sesenta anos como se comproba en aplicacións tales como
tubaxes para condución de auga potable e sanitarios; de acordo ao estado
das instalacións espérase unha prolongada duración do PVC así como
ocorre cos marcos de portas e xanelas.
Debido aos átomos de cloro que forman parte do polímero PVC, non se
queima con facilidade nin arde por si só e cesa de arder unha vez que a
fonte de calor retirouse.
Emprégase eficazmente para illar e protexer cables eléctricos no
fogar, oficinas e nas industrias debido a que é un bo illante eléctrico.
Vólvese flexible e moldeable sen necesidade de sometelo a altas
temperaturas (basta uns segundos exposto a unha chama) e mantén a forma
dada e propiedades unha vez arrefriado a temperatura ambiente, o cal
facilita a súa modificación.
Existe un debate acerca da toxicidade do PVC. Mentres que a
industria do PVC nega os seus posibles efectos tóxicos sobre a saúde e o
medio ambiente, certos colectivos e organizacións ecoloxistas denuncian
que a inhalación prolongada de cloruro de vinilo podería ser a causa de
doenzas no fígado e cancro.
POLIESTIRENO (PS):
O poliestireno (PS) é un polímero termoplástico que se
obtén da polimerización do estireno, ou etenilbenceno.
Existen catro tipos principais: o PS cristal ou GPPS (do inglés:
Xeneral Purpose Polystyrene), que é transparente, ríxido e quebradizo; o
poliestireno de alto impacto ou HIPS (do inglés: High Impact Polystyrene),
resistente ao impacto e opaco esbrancuxado; o poliestireno expandido ou
EPS (do inglés: Expandable Polystyrene; PSE en francés), moi lixeiro; e
o poliestireno extruído, similar ao expandido pero máis denso e
impermeable.
As aplicacións principais do PS de alto impacto e o PS cristal son
a fabricación de envases mediante extrusión-termoformado, e de obxectos
diversos mediante moldeo por inxección.
As formas expandida e extruída empréganse principalmente como
illantes térmicos en construción e para formar embalaxes de obxectos
fráxiles. O EPS tamén é utilizado para a produción de caixas de peixe ou
neveiras para o transporte de vacinas, pola súa capacidade illante.
A primeira produción industrial de poliestireno cristal foi
realizada por BASF, en Alemaña, en 1930. O PS expandido e o PS de alto
impacto foron inventados nas décadas seguintes. Desde entón os procesos
de produción melloraron substancialmente e o poliestireno deu lugar a
unha industria sólidamente establecida. O poliestireno é hoxe o cuarto
plástico máis consumido, por detrás do polietileno, o polipropileno e o
PVC.
O poliestireno de alto impacto utilízase principalmente na
fabricación de obxectos mediante moldeo por inxección. Algúns exemplos:
carcasas de televisores, impresoras, portas e interiores de
frigoríficos, maquinillas de afeitar refugables, xoguetes. Segundo as
aplicacións pódenselle engadir aditivos por exemplo substancias
ignífugas ou colorantes.
O poliestireno cristal utilízase tamén en moldeo por inxección alí
onde a transparencia e o baixo custo son importantes. Exemplos: caixas
de CD, perchas, caixas de ovos. Outra aplicación moi importante é na
produción de escumas ríxidas, denominadas ás veces "poliestireno
extruido" ou XPS, a non confundir co poliestireno expandido EPS. Estas
escumas XPS utilízanse por exemplo para as bandexas de carne dos
supermercados, así como na construción.
A forma expandida (poliestireno expandido) EPS, utilízase como
illante térmico e acústico e é amplamente coñecido baixo diversas marcas
comerciais (Poliexpan, Telgopor, Emmedue, Icopor, etc.).
A forma extruída (poliestireno extruido) XPS, emprégase como
illamento térmico en chans, debido á súa maior resistencia mecánica, e
tamén como alma en paneis sandwich de fachada. Pero o seu uso máis
específico é o de illante térmico en cubertas investidas, onde o
illamento térmico colócase encima do impermeabilizante, protexéndoo das
inclemencias do tempo e alongando a súa vida útil.
Os materiais plásticos que podemos atopar á venda
presentan uns símbolos que nos anuncian o tipo de plástico de que se
trata e a posibilidade de ser reciclado. Neste caso, o símbolo de
reciclaxe está formado por un triángulo de tres frechas que conteñen un
número e unhas letras que sinalan o tipo de material. Podemos atoparnos
no mercado os seguintes símbolos:
Estes son algúns exemplos de plásticos que podemos
atopar por casa ou cando imos ao súper.
PET ou PETE (Polietileno tereftalato) 1. É un dos
plásticos máis comúns, é lixeiro, non é caro e é facilmente reciclable,
usado sobre todo para envasar alimentos e bebidas. A maioría das
botellas de auga que se comercializan en España están feitas a partir de
PET. Unha vez reciclado, pódese utilizar, por exemplo, na elaboración de
fibras téxtiles e pezas de automóbil.
 |
 |
| Botella de auga mineral |
Bote de maionesa |
 |
 |
| Botella de aceite |
Envase de lavalouzas |
HDPE (Polietileno de alta densidade) 2. Grazas á
súa versatilidade e resistencia química utilízase, sobre todo, en
envases, en produtos de limpeza de fogar ou químicos industriais, como
botellas de champú, deterxente, cloro etc. Recíclase de moi diversas
formas, como en tubos, botellas de deterxentes e limpadores, mobles de
xardín etc.
 |
 |
| Bolsa de supermercado |
Bolsa de supermercado |
 |
 |
| Bote de champú |
Bote de xel de baño |
 |
 |
| Envase de limpiador vitrocerámicas |
Envase de deterxente |
V ou PVC (Vinílicos ou Cloruro de Polivinilo) 3.
É moi resistente. Non se usa para alimentos, senón para a fabricación de
produtos de alta resistencia como xanelas ou materiais para construción.
Unha vez reciclado, pode servir para a fabricación de paneis, tarimas,
tapetes etc.. O PVC pode soltar diversas toxinas (non hai que queimalo
nin deixar que toque alimentos).
PEBD (Polietileno de baixa densidade) 4. Este
plástico forte, flexible e transparente pódese atopar nalgunhas botellas
e bolsas moi diversas (da compra ou para comida conxelada, pan, etc.),
algúns mobles e alfombras, entre outros. Tras a súa reciclaxe, pódese
utilizar de novo en contedores e papeleiras, sobres, paneis, tubaxes ou
baldosas.
 |
 |
|
Envase de rolos de cociña
|
Envase de rolos de papel hixiénico
|
PP (Polipropileno) 5. O seu alto punto de fusión
permite envases capaces de conter líquidos e alimentos quentes.
Utilízase na fabricación de envases médicos, iogures, palliñas, botes de
ketchup, tapas, algúns contedores de cociña, etc. Ao reciclarse pódense
obter sinais luminosos, cables de batería, basoiras, cepillos, angazos,
cubos, bandexas etc.
 |
 |
| Envase de pasta |
Envase de panos de papel |
 |
 |
| Caixa de CDs |
Caixa de CDs |
 |
 |
| Recipiente cociña |
Envase de deterxente |
PS (Poliestireno) 6. Utilizado en pratos e vasos
de usar e tirar, caixas de ovos, bandexas de carne etc. O seu baixo
punto de fusión fai posible que poida derretirse en contacto coa calor.
Tras a súa reciclaxe, pódense obter diversos produtos como material para
edificación, illantes etc.
 |
 |
| Caixa de CDs |
Caixa de bombóns |
 |
 |
| Bandexa de supermercado |
Envase de escarvadentes |
Outros plásticos 7. Neste caixón de xastre
inclúense unha gran diversidade de plásticos moi difíciles de reciclar,
como o policarbonato, e que serven para elaborar DVD´s, lentes de sol,
MP3 ou PC´s.
 |
 |
| Bolsa de pistachos |
Envase de toalliñas húmidas |
 |
 |
Xarra filtradora de auga
SMMA - Estireno metilmetacrilato
SAN - Estireno acrilonitrilo |
Xarra filtradora de auga
ASA - Acrilonitrilo estireno acrilato
ABS - Acrilonitrilo butadieno estireno |
Como variantes destes símbolos de materiais plásticos
pódense atopar só cos números, sen os acrónimos, ou co anel máis groso
de Moebius e, no seu interior, o número que corresponda. Se o acrónimo
leva unha "R" diante, significa que o produto contén materiais plásticos
reciclados. Pola súa banda, se o símbolo leva o acrónimo ABS, refírese
ao acrilonitrilo butadieno estireno, un plástico moi duro utilizado en
automoción e en usos tanto industriais como domésticos.
EXERCICIOS
PARA PRACTICAR
Unha visión crítica sobre o abuso dos plásticos, por
Annie Leonard:
Está claro que non todo o plástico recíclase. Gran parte
dos plásticos que usamos vai parar ao océano. Pero o mar non os destrúe.
Esta enorme cantidade de plástico en pequenos fragmento está a poñer en
perigo os ecosistemas mariños.

|
